
抗体由两条相同的重链和两条相同的轻链组成,是一种呈现Y形结构的糖蛋白(~150kDa)。重链和轻链的可变区负责与抗原结合,而恒定区则与免疫系统的其他成分作用产生相应效应功能。重链轻链可变区均包含三个超变环,称为互补决定区(CDR1、CDR2和CDR3)。CDR区被称为框架区(FR1、FR2、FR3和FR4)的结构保守区域间隔开,这些区域形成可变区“核心”β片结构,超变环展示在其表面。CDR序列的长度和组成变化很大,尤其是CDR3。在抗体工程过程中通常需要精确鉴定对抗体与其靶抗原的相互作用和/或亲和力有影响的残基,需要准确鉴定出CDR区。本文介绍了现阶段常用的抗体编号方案,并比较解释了由此方案定义CDR的优势与不足。
随着抗体测序和晶体分析技术的不断发展,各种序列和结构数据库数量显著增加,使得人类和动物免疫球蛋白的可变区的比较成为可能。1970年,Kabat和Wu比对了77个Bence-Jones蛋白和免疫球蛋白轻链序列,研究抗体可变区连续位置氨基酸组成的统计学上的变异性。他们将“变异性”定义为给定位置上不同氨基酸的数量除以该位置上出现最多氨基酸的频率。该分析揭示了轻链可变区中的三个高变区,并证明了高度保守的残基的存在。例如在抗体结构域内核心形成二硫键的两个半胱氨酸和位于CDRL1后的色氨酸残基。同样,在重链可变区也发现了三个相应的高变区。Kabat等假设这些高变区会聚集在折叠结构域的一侧,形成负责特异性抗原识别的表面,并将这些高变区称为互补决定区(CDR1、CDR2和CDR3)。这一假设后来得到证实,并进一步研究区分这些CDR中抗原结合或构象的重要残基。
1979年,Kabat等首次提出了抗体可变区的标准化编号方案。在他们编制的《免疫学意义蛋白质序列》中,对抗体重链和轻链(λ,κ)的可变区以及T细胞受体(α,β,γ,δ)的可变区的氨基酸序列进行了比对和编号。他们观察到,分析的序列表现出可变的长度,并且只能在精确的位置产生缺失和插入。有趣的是,插入点位于CDR内部(除CDRL2),以及位于框架区内的部分位置。在这套编号方案中,这些插入残基可以被识别并用字母注释(例如,27a、27b……)。值得注意的是,所有λ轻链中都不存在残基L10,因为λ和κ链由位于不同染色体上的两个不同基因编码。
尽管Kabat编号方案被广泛采用,但它有一些局限性:首先,该方案建立在有限数量具有常见序列长度的抗体的序列比对之上。因此,在CDR或框架区中具有非常规插入或缺失的序列不包括在内。其次,Kabat编号方案与抗体的3D结构不能很好地匹配。事实上,Kabat定义的高变区与抗原结合环结构并不完全匹配。CDRL1(L27)和CDRH1(H35)中定义的插入位点与其在结构中的相应位置不匹配,换言之,CDRL1和CDRH1中晶体结构中相应的残基(拓扑对齐)与Kabat编号方案中编号不同。
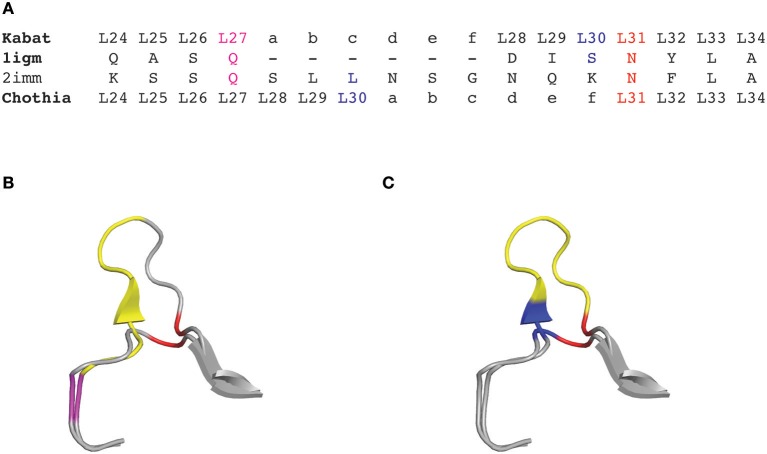
图1 轻链可变区1igm和2imm根据Kabat和Chothia编号方案CDRL1氨基酸插入位置
(A)Kabat/Chothia编号方案1igm和2imm CDRL1的氨基酸序列
(B)根据Kabat编号方案(C)根据Chothia编号方案1igm和2imm的CDRL1环的飘带图
1987年,Chothia等为抗体可变区引入了基于结构的编号方案。他们对抗体可变区的晶体结构进行了比对,定义了形成CDR的环结构,并校正了CDRL1和CDRH1插入点的位置编号,以便更好地拟合其拓扑位置(图1)。
根据抗体结构的比对,Chothia编号方案将氨基酸插入点从L27移动到L30,H35移动到H31。值得一提的是,Chothia CDR的定义与抗体环结构的对应更好。Chothia鉴定的CDRH3环结构与Kabat高变区匹配性较好,相比之下其他环比Kabat定义的超变序列短(CDRH1除外)。根据Kabat编号方案高变氨基酸基础上定义的CDR和基于Chothia编号方案的环拓扑结构的CDR对于部分CDR有位置移动和/或环长度偏离(图2)。

图2 1kiq结构根据Kabat(A、C)和Chothia(B、D)编号方案在CDR定义上的差异
A、B为轻链,C、D为重链可变区3D结构,框架区用灰色表示,CDR用红色表示
Chothia编号方案的主要优点在于不同抗体拓扑对齐残基位于相同的位置编号,并且Chothia CDR定义在大多数抗体序列中对应于抗原结合环。然而,与Kabat或IMGT编号方案相比,这种编号方案的使用有限,可能产生混淆。此外,Chothia等后来发表的一项研究将CDRL1中的插入点从L30更改为L31,但大型数据库研究抗原结合环构象时还是沿用最初的L30位置。轻链也是如此,他们将λ链L93插入点移动到L95。与Kabat编号方案类似,Chothia编号方案的一个重要限制是忽略了非常规长度的序列。也同样可以通过定义新的插入点来优化该系统。
Martin等2008年的研究重点关注非常规长度的不同框架区的结构比对。他们指出了大多数序列和结构中不存在的残基,并将其定义为缺失位置。通过分析序列和结构,他们提出重链FR3内的插入点应从H82改到H72。此外,通过与CDRH2的类比,将CDRL2的插入点位置修改到L52。
他们在Chothia编号系统的基础上提出了一种新的编号方案,并开发了新的编号软件ABnum(http://www.bioinf.org.uk/abs/abnum/)。该软件使用了更大的Abysis数据库,集成了来自Kabat、IMGT和PDB数据库的序列。ABnum在Chothia和Kabat编号方案中H6定义了一个新的插入/缺失位置,而Martin编号方案这个位置在H8。
Martin编号方案应被视为Chothia编号的新版本。通过分析大型数据库上的序列和结构,可以校正插入位置,定义新的插入位置并突出显示缺失的位置,更好地拟合残基的拓扑位置。
一些研究中使用的另一种有趣的编号方法是Gelfand等描述的编号方法。这种编号系统选用了相对复杂的命名方法。可变区序列被分成21个片段,称为“word”,这些“word”中的每一个都与二级结构元素(strand或loop)匹配。strand区由按顺序排列的字母定义(例如,A、B、C),loop区由对应于相邻strand的两个字母定义(例如,AB、BC…..)。该定义有两个例外:可变区的三个N端残基(称为OA)和连接B和C strand的loop环,因为它存在一个“双跨桥”构象(图3),这个loop分为两个word,分别为BC和CB。该编号系统不包括插入或缺失点,但可以对比对序列之间的二级结构进行精确比较。同样值得注意的是,Gelfand对loop的定义与Chothia的并不完全对应。
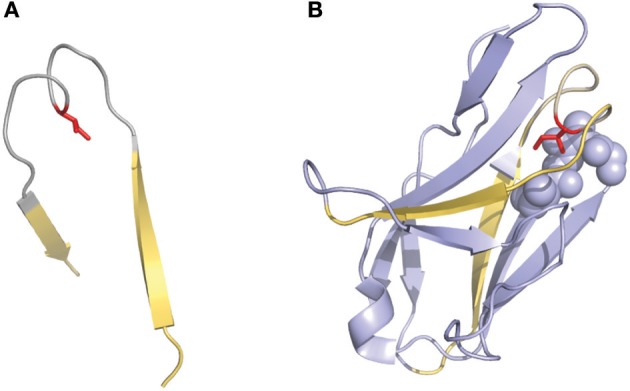
图3 2fb4抗体结构中存在的CDRL1的“双跨桥”构象
双跨桥用灰色表示,边界strand用黄色表示
(A)Ile侧链(红色)指向loop环结构内部(B)完整的结构域
1997年,Lefranc等为免疫球蛋白超家族的所有蛋白序列引入了一种新的标准化编号系统,包括来自抗体重链轻链和的可变区以及来自不同物种的T细胞受体链。该编号方案开始基于种系V基因的氨基酸序列比对,氨基酸序列和编号在CDR3开始的地方停止。后来,Lefranc将编号方案扩展到整个可变区,并开发了各种工具来分析全长序列。IMGT拥有自己的框架区(称为FR-IMGT)和CDR(称为CDR-IMGT)定义。
IMGT编号方案根据种系V序列比对从1到128连续计数残基。除了在位置111和112之间具有13个以上氨基酸的CDR3-IMGT,无其他插入位置。当特定序列中缺少残基时,则该编号为空。例如,在6个氨基酸长的CDR1-IMGT中,残基#27后跟残基#34(编号#28–#33无残基)。根据Kabat、Chothia和IMGT编号方案的比对示例如图4所示。
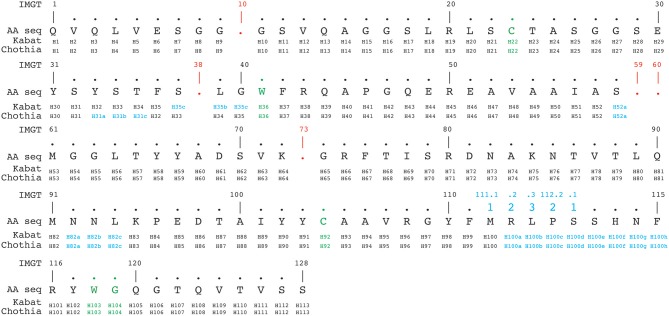
图4 根据Kabat、Chothia和IMGT编号方案对3dwt纳米抗体序列进行比对
IMGT是免疫遗传学和免疫信息学的重要参考。其定义,包括其氨基酸编号方案已得到广泛认可,并被世界卫生组织国际免疫学会联合会使用。这种编号方案的主要优点是基于来自包括整个免疫球蛋白超家族的完整参考基因数据库的序列比对。相应工具也不断开发,如氨基酸比对和编号可以通过IMGT/DomainGapAlign执行。该工具还能够通过识别编码可变区的相应VDJ基因来分析序列多态性。IMGT与另一个有趣的程序相结合,称为IMGT-“CollierdePerles”,可以一目了然地看到氨基酸2D位置,并且还可以轻松标注FR-IMGT和CDR-IMGT。
然而,由于氨基酸沿序列连续编号,IMGT编号方案无法直观地显示插入位置,即使对于最常见的插入位置也是如此。在Kabat和Chothia编号系统中,氨基酸插入点的位置很容易合并;将IMGT方案应用于具有新氨基酸插入的潜在序列更加困难。必须注意的是,IMGT将插入片段置于CDR的末尾,这与抗体结构无关。这个问题在后来的V-Quest软件中得到了纠正,该软件将插入片段放在CDR-IMGT的中间,这与实际结构数据更匹配。
Honegger编号方案以均一化格式对免疫球蛋白超家族的可变区进行编号。该系统基于免疫球蛋白可变区3D结构的结构对齐,覆盖观察到的长度变化。它允许定义结构保守的Cα位置,并推断出适当的框架区和CDR长度(图5)。
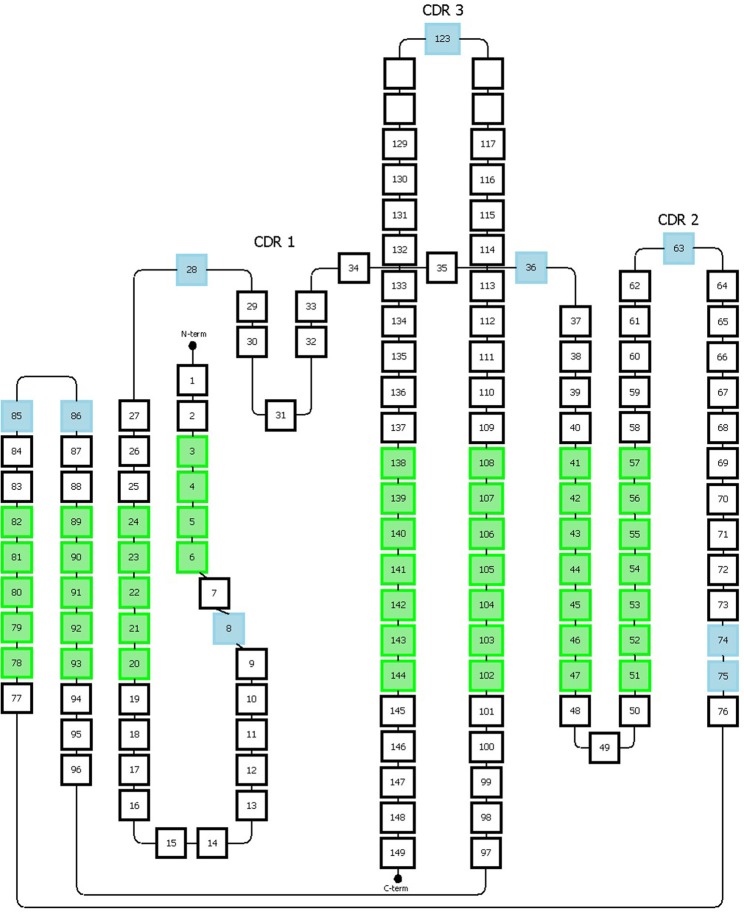
图5 Honneger编号方案
提供缺失位置的氨基酸用蓝色表示;绿色位置对应于结构保守的残基,其Cα位置用于结构叠加
Honegger编号方案还定义了保守残基(C23、W43、C106、G140)和特定位置的缺失(#27-28、#36、#63、#123)。CDR1具有“双跨桥”构象,该构象由位置#31处的保守疏水残基深入结构中产生,将loop环分为两个部分。Honegger方案描述了位于这两个部分上的两个缺失区域,一个位于第一部分#27和#28,另一个位于第二部分#36。该方案考虑了loop环两端存在的插入位点的可变性。此外,另外两个插入点分别位于位置#74和#75,以反映T细胞受体α表现出的CDR2环的较短C端分支。额外的缺失位置在CDR2和CDR3环的中间。通过进一步的结构分析,他们提出了将Vκ链插入缺失从最初L10移动到L8。
Honegger编号系统的主要优点在于它基于结构比对,可以更好地匹配抗体3D结构特征。此外,Honegger在CDR1和CDR2中包含两个缺失,非常适合对免疫球蛋白超家族中的所有蛋白进行编号。然而,与IMGT方案类似,Honegger会跳过部分顺序编号,这在分析序列编号时可能会令人困惑。这种编号方案也不太灵活,无法适用于具有新插入或较大插入的免疫球蛋白。结构最保守位置的分析仅来自28个不同的结构,通过针对特定类型的免疫球蛋白(例如抗体)的可变区调整方案,可能可以更好地定义框架区。
| Loop | Kabat | AbM | Chothia | IMGT |
|---|---|---|---|---|
| L1 | L24-L34 | L24-L34 | L26-L32 | L27-L32 |
| L2 | L50-L56 | L50-L56 | L50-L52 | L50-L51 |
| L3 | L89-L97 | L89-L97 | L91-L96 | L89-L97 |
| H1(Kabat Numbering) | H31-H35B | H26-H35B | H26-H32..34 | H26-H35B |
| H1(Chothia/Martin Numbering) | H31-H35 | H26-H35 | H26-H32 | H26-H33 |
| H2 | H50-H65 | H50-H58 | H52-H56 | H51-H56 |
| H3 | H95-H102 | H95-H102 | H96-H101 | H93-H102 |
参考文献
[1]Dondelinger M, Filée P, Sauvage E, et al Understanding the Significance and Implications of Antibody Numbering and Antigen-Binding Surface/Residue Definition. Front Immunol. 2018 Oct 16;9:2278.
[2]Martin, A.C.R. Protein Sequence and Structure Analysis of Antibody Variable Domains. In: Kontermann, R., Dübel, S. (eds) Antibody Engineering. Springer Lab Manuals. Springer, Berlin, Heidelberg,2001.
兔单抗凭借其精细的表位识别、高亲和力、高特异性和稳定性,已成为研究、诊断和治疗应用中的杰出试剂。这些特性也使兔子成为抗体体内发现极具吸引力的替代品。兔抗与其他物种的抗体相比,结构也略有不同。兔IgG一个显著特征就是存在非经典二硫键。这些键常见于kappa链Cys80和Cys170(C80-C170)之间,以及重链CDR1 Cys35a和CDR2 Cys50(C35a-C50)之间。已有研究对C80-C170二硫键进行表征,并发现此二硫键的存在有助于提升抗体的热稳定性。与C80-C170二硫键不同,含有C35a-C50二硫键的兔单抗通常被认为具有一种“负担”,即使其他方面的性能符合要求,通常也会被排除于临床治疗候选抗体之外。
程序性死亡受体1(PD-1)是重要的免疫检查点受体,通过与两个配体PD-L1和PD-L2的作用抑制T细胞的活化及细胞因子的产生,已被证实是癌症免疫疗法最有前途的靶点之一。临床前小鼠模型是进行药效、药代动力学和毒性研究的重要工具,但开发出人鼠交叉的PD-1抗体难度较高。研究人员利用单B细胞抗体发现平台开发了抗PD-1兔单抗,但筛选出的所有人鼠交叉且阻断PD-L1的PD-1抗体都含有C35a-C50二硫键,这表明这种二硫键可能具有某些功能作用,并且可能影响这些候选抗体在人源化后的进一步发展。
这些兔单抗与人PD-1(hPD-1)和食蟹猴PD-1(cynoPD-1)具有相似的亲和力,对小鼠PD-1(mPD-1)的亲和力范围更广,且大多数对hPD-L1和mPD-L1显示完全阻断(最大抑制作用大于90%)。同时,这些兔单抗还与hPD-1和mPD-1高表达细胞株具有较强的结合。通过对hPD-1的表位分析(epitope binning)发现,所有具有交叉反应的抗体都聚集在同一个分箱中,并与帕博利珠单抗(pembrolizumab)的表位重叠。
为了进一步了解这种重链间非经典二硫键对抗体稳定性和抗原结合活性的影响,研究人员选择了其中一株亲和力最高的人鼠交叉PD-L1阻断兔单抗(rbt1340),并将这株抗体人源化,选取了对三种PD-1表现出最高的亲和力,且对hPD-1/hPD-L1和mPD-1/mPD-L1相互作用的抑制作用最高的一株人源化兔单抗(h1340.CC,CC指包含C35a-C50二硫键)。研究人员还制备了去除了C35a-C50二硫键的h1340.CC变体h1340.SA:将C35a突变为丝氨酸,将C50突变为丙氨酸。结果发现,与rbt1340相比,h1340.CC在物种间的亲和力损失仅为2~3倍,h1340.SA对人、食蟹猴和小鼠PD-1的亲和力分别降低了4倍、6倍和10倍。
表1 rbt1340、h1340.CC、h1340.SA与三种PD-1的亲和力
| Antibody | Human PD-1 KD/nM | Cyno PD-1 KD/nM | Mouse PD-1 KD/nM |
|---|---|---|---|
| rbt1340 | 0.18 | 0.24 | 0.67 |
| h1340.CC | 0.3 | 0.42 | 1.72 |
| h1340.SA | 0.72 | 1.3 | 7.1 |
在分辨率为2.3 Å条件下对h1340.CC Fab与hPD-1结合的晶体结构进行解析,从残基Arg30到Arg143对PD-1进行建模(对应于残基59-60、71-72和85-92的无序loop区除外),结果观察到h1340.CC Fab和PD-1之间存在广泛的结合界面,且与PD-L1的结合界面部分重叠。h1340.CC的所有CDR参与与PD-1的结合,并与PD-1形成三个主要的相互作用界面。
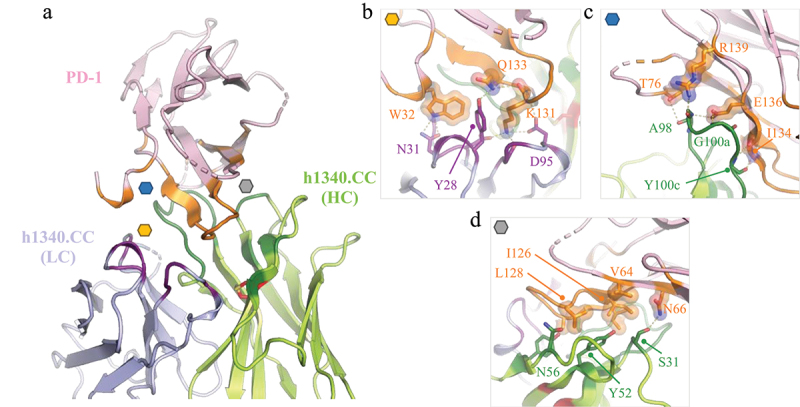
图1 h1340.CC Fab与hPD-1结合构象
第一主要相互作用界面由PD-1残基Trp32、Lys131和Gln133形成,它们在由CDR L1、L2、L3和H3残基形成的口袋中结合(图1b)。PD-1残基Trp32和Gln133分别与CDRL1 残基Asn31和Tyr28形成氢键。其他关键接触涉及PD-1残基Lys131,它与CDRL3 Tyr92骨架羰基形成氢键,并与CDRL1残基Asp32和CDRL3残基Asp95形成盐桥,而PD-1残基Ala132与CDRL3 Asp95形成氢键。
第二个界面由侧链形成——PD-1残基Thr76、Glu136和Arg139与CDRH3残基Ala98、Gly99和Gly100a之间的极性相互作用,以及PD-1残基Ile134和CDRH3残基Tyr100c之间的氢键(图1c)。
最后,PD-1残基Asn66和CDRH1残基Ser31之间的氢键以及PD-1(残基Val64、Ile126、Leu128、Ala132和Ala134)上的疏水斑块与CDRH1、H2和H3的芳香基团和极性基团的脂肪族部分相互作用,形成了第三个主要相互作用界面(图1d)。
人、食蟹猴和小鼠PD-1的序列分析解释了h1340.CC物种交叉反应的原因:hPD-1与h1340.CC Fab CDR直接接触的关键残基在cyno PD-1中都是保守的,而在mPD-1中,这些残基中存在三处不同(图2)。事实上mPD-1中保守的Gln133Lys取代可能可以保持与CDRL1残基Asn31的氢键,但Tyr68Asn和Arg139Gly取代可能导致CDRH1和CDRH3失去两个氢键。

图2 人、食蟹猴和小鼠PD-1的表位比较
半胱氨酸残基C35a和C50位于面向轻链的相邻β折叠股中,不参与与hPD-1的任何直接相互作用。但二硫键对CDRH3残基L100e和L100h具有支撑作用,可能在稳定CDRH3构象及其与hPD-1的广泛相互作用界面上发挥重要作用(图3)。此外,在靠近二硫键的地方,CDRH1残基W34和CDRH2残基Y52与hPD-1残基Ile126、Leu128、Ala132和Ile134形成疏水斑块。
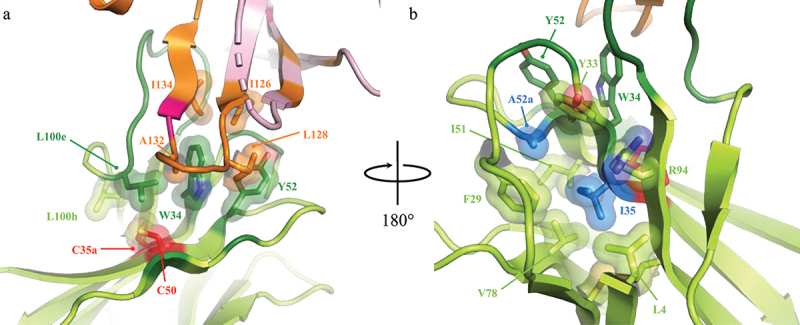
图3 h1340.CC二硫键的结构背景
h1340.CC重链以淡绿色表示,其关键残基以深绿色表示;C35a-C50二硫键用红色表示;与hPD-1残基Ile126、Leu128、Ala132和Ile134形成疏水相互作用的关键残基以球棍模型表示;人类和小鼠PD-1的不同残基(Y68N和Q133K)用亮粉色表示。
在理解相互作用结构的基础上,研究人员试图减轻去除非经典C35a和C50二硫键而导致的亲和力损失。去除二硫键可能会影响CDRH1-H2区域向CDRH3残基L100e和L100h的折叠,从而影响CDRH1或H2、H3构象,导致与hPD-1结合的变化。如前所述,突变C35a→S和C50→A导致对mPD-1的亲和力降低~4倍,但对hPD-1的亲和力仅降低~2.5倍。从序列结构的分析来看,没有明显的理由在去除二硫键后,与mPD-1的结合比hPD-1的结合损失更多,这可能是由于mPD-1中Y68N和R139G的差异,两个氢键的潜在丢失可能使mPD-1更容易受到去除二硫键导致的弱相互作用的影响。
综上,研究人员将C35、C50两个位置上突变为疏水性氨基酸(Val、Ile和Leu),此外还尝试将C50保守突变为Ser或Thr 5个变体。结果发现,与h1340.SA相比,这些变体均未产生更高的亲和力。
进一步的结构分析发现,将残基I35和/或A52a突变为较大的残基可能可以改善疏水核心的折叠,从而支撑β折叠,改善或稳定W34和Y52与hPD-1的相互作用。通过将h1340.SA、h1340.VS(C35a→V,C50→S)的I35突变为Leu或Met,A52a突变为Val、Ile或Leu,进一步测试变体的亲和力。具有额外突变I35→L和A52a→V的h1340.SA变体(h1340.SA.LV)对hPD-1的亲和力在亲本克隆h1340.CC两倍内得到改善。
通过表面等离子体共振(SPR)比较h1340.CC与h1340.SA.LV和hPD-1、CynoPD-1和mPD-1的亲和力活性,发现KD值差异小于2.5倍。
表2 h1340.CC和h1340.SA.LV与三种PD-1的亲和力
| Antibody | Human PD-1 KD/nM | Cyno PD-1 KD/nM | Mouse PD-1 KD/nM |
|---|---|---|---|
| h1340.CC | 0.45 ± 0.07 | 0.63 ± 0.14 | 1.91 ± 0.23 |
| h1340.SA.LV | 0.80 ± 0.05 | 1.51 ± 0.08 | 3.82 ± 0.11 |
通过FACS评估两株抗体在与hPD-1、mPD-1高表达细胞株结合活性及在阻断PD-1/PD-L1相互作用方面的表现,发现其与上市药物帕博利珠单抗和纳武利尤单抗(Nivolumab)具有相似的IC50。
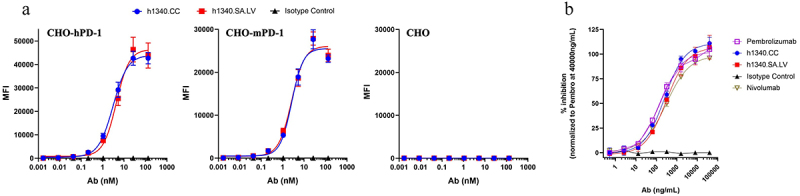
图4 h1340.CC和h1340.SA.LV在结合和阻断方面的功能表征
评估两株抗体的潜在免疫原性是通过FACS检测健康供体的外周血单一核细胞(PBMC)与抗体共孵育7天后CD4 T细胞的增殖情况。使用刺激指数(SI),即存在或不存在测试抗体时BrdU/CD3CD4 T细胞的百分比比率确定每个供体的反应。结果表明,两株抗体在阳性供体中诱导的T细胞增殖具有相似的SI值(13~17%),即都具有低免疫原性潜力。
抗体可开发性评估主要包括抗体的热稳定性、化学稳定性、黏度与浊度。
在高浓度(150 mg/mL)下对h1340.CC和h1340.SA.LV进行热稳定性检测,并评估其转化为高浓度制剂的可能性。在30°C下储存一个月后,通过尺寸排阻色谱法(SEC)评估了抗体的聚体和片段化程度,并通过离子交换色谱法(IEC)评估了电荷异构体的变化。尽管非经典二硫键可能导致半胱氨酸不成对或二硫键乱配,从而导致抗体聚集,但实际上未观察到h1340.CC的聚集增加。此外,虽然h1340.SA.LV IEC观察到主峰的降幅更大,但这种变化在测定变异性范围内,表明两种变体在高浓度热应力下表现相似。
使用2,2′-偶氮二(2-脒基丙烷)二盐酸盐(AAPH)对两株抗体进行化学胁迫时,可以观察到h1340.SA.LV在W34处的氧化高于h1340.CC(分别为36%和1%),表明该区域的溶剂可及性增加。根据结构分析,该残基与非经典二硫键的紧密接近,去除二硫键会破坏该区域的稳定性并增加CDRH1环的灵活性。在热应激或氧化应激后,通过肽图分析未观察到任何天冬酰胺、天冬氨酸、蛋氨酸或色氨酸残基在任一变体的CDR中的氧化差异。
除了热稳定性和化学稳定性外,抗体的黏度也是影响生产过程的关键特性。在高离子强度缓冲液中测量了两株抗体在高浓度下的黏度,h1340.CC的黏度略高于h1340.SA.LV,都远低于不可开发的黏度阈值,因此不会对生产过程构成风险。
最后,为了了解对给药的影响,将高浓度样品透析到PBS中来评估两株抗体的溶解度,透析后测量的浊度没有观察到差异。
表3 h1340.CC和h1340.SA.LV的理化性质分析
| Antibody | SEC | IEC | 黏度cP | 浊度OD | ||||
|---|---|---|---|---|---|---|---|---|
| 高分子量形式变化/% | 单体变化/% | 低分子量形式变化/% | 酸性变化/% | 主峰变化/% | 碱性变化/% | |||
| h1340.CC | 0.9 | −1.3 | 0.4 | 5.0 | −7.0 | 2.0 | 13.0 | 0.22 |
| h1340.SA.LV | 0.8 | −1.2 | 0.4 | 6.7 | −7.7 | 1.0 | 11.0 | 0.22 |
研究人员同时利用ProteinMPNN,一种基于深度学习的蛋白质序列设计算法设计抗体序列。ProteinMPNN使用蛋白质骨架特征作为输入,根据计算机生成或实验得出结构生成新的氨基酸序列。使用h1340.CC Fab与hPD-1结合结构作为输入,并保持hPD-1和h1340.CC的轻链序列固定,生成h1340重链序列。生成的重链序列约有一半的含有C35a-C50二硫键,22%的序列在残基35a-50处含有丙氨酸-丙氨酸对,而只有11%的序列含有丝氨酸-丙氨酸对,也就是使用序列分析方法中所获得的最优变体。
表4 ProteinMPNN设计的h1340重链中35a-50残基对频率
| 变体名称 | 35a−50残基对 | 频率/% |
|---|---|---|
| h1340.CC | Cys-Cys | 47 |
| h1340.AA | Ala-Ala | 22 |
| h1340.SA | Ser-Ala | 11 |
| h1340.VA | Val-Ala | 9 |
| h1340.GA | Gly-Ala | 6 |
| h1340.LA | Leu-Ala | 5 |
重点关注含有AA、SA和VA残基对,且突变发生频率大于等于50%的序列。排除暴露于溶剂、远离抗原结合位点、可能会降低亲和力的残基,最终保留了6个突变位点。
检测生成变体与hPD-1的亲和力发现(表5),单个位点突变变体中(h1340.SA.1-6)有三个变体亲和力高于h1340.SA(图5):突变S30→D可能与PD-1残基K78产生强氢键,K78在人、小鼠和食蟹猴中保守;与A52a→V类似,A52a→L突变可以改善疏水核心的折叠,支持CDRH1关键残基W34和CDRH2关键残基Y52与PD-1的相互作用;A95→S突变可以与T100d的羰基骨架产生氢键,从而形成CDRH3环状构象。
表5 基于结构和机器学习设计的h1340.CC变体的相对亲和力
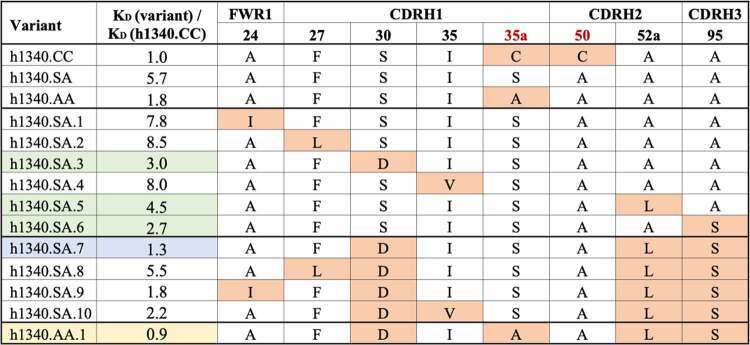
*与h1340.SA相比,变体的序列差异以橙色突出显示;单个残基突变的变体亲和力提高以绿色突出显示;SA或AA骨架的最佳变体分别以蓝色和黄色突出显示。
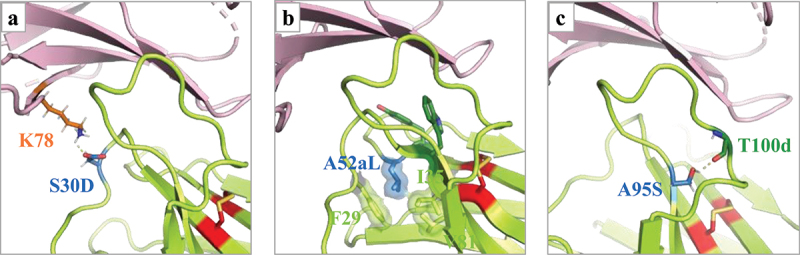
图5 基于结构和机器学习设计变体的结构分析
h1340.SA.7和h1340.AA.1与初始的h1340.CC亲和力比较分析表明,两种变体与hPD-1和cyno PD-1的亲和力损失小于1.5倍,与mPD-1的亲和力损失小于2.5倍。综上,基于结构和机器学习的二硫键去除可以快速有效地生成具有改进特性的抗体变体。
表6 h340.SA.LV、h1340.SA.7和h1340.AA.1与三种PD-1的亲和力
| Antibody | Human PD-1 KD(nM) | Cyno PD-1 KD(nM) | Mouse PD-1 KD(nM) |
|---|---|---|---|
| h1340.CC | 0.45 ± 0.07 | 0.63 ± 0.14 | 1.91 ± 0.23 |
| h1340.SA.LV | 0.80 ± 0.05 | 1.51 ± 0.08 | 3.82 ± 0.11 |
| h1340.SA.7 | 0.62 ± 0.03 | 1.05 ± 0.09 | 3.66 ± 0.35 |
| h1340.AA.1 | 0.60 ± 0.08 | 1.09 ± 0.18 | 4.34 ± 0.48 |
非经典二硫键在兔、鸡、骆驼、鲨鱼和牛抗体中普遍存在,它们在产生多样化的抗体库中起着至关重要的作用,扩大互补位空间,介导与抗原之间不同结构和功能相互作用。之前普遍认为,为了将源自这些物种的有价值的单克隆抗体改造为治疗药物,在药物开发过程中必须去除CDR内部和外部的非经典二硫键。在兔单抗中,轻链结构域之间的非经典C80-C170二硫键可以很容易地通过丙氨酸诱变去除,不会对蛋白表达及构建体外噬菌体展示的免疫文库而使用特定品系的动物(Basilea兔和b9兔)产生不利影响。相比之下,重链CDR1和CDR2之间的非经典C35a-C50二硫键不易去除。因此,尽管在其他方面具有良好的特性,此类抗体通常不会被优先考虑。事实上,在去除含有非经典C35a-C50二硫键的抗PD-1兔源单克隆抗体的过程中发现,通过结构序列分析及机器学习的方法可以快速有效改善抗体特性,也证明了兔单抗中发现的非经典二硫键并不一定构成治疗性抗体开发的阻碍。正确的评估兔源性抗体的可开发性,减少对兔源性抗体成药性的偏见可以丰富候选抗体分子数量,从而筛选到更优的临床候选药物。未来也需要更多的研究和临床验证证明结果的普遍性。
参考文献
Liang WC., Xi H, Sun D., et al. Structure-and machine learning-guided engineering demonstrate that a non-canonical disulfide in an anti-PD-1 rabbit antibody does not impede antibody developability. mAbs, 2024:16(1).
IgG中的二硫键结构在进化过程中是高度保守的,并曾被认为是一个统一的、同质的结构特征。然而,大量IgG的详细表征揭示了天然人源和重组IgG抗体的几个新结构特征。
IgG抗体的四个亚型:IgG1、IgG2、IgG3、IgG4,其二硫键结构存在许多相似与不同之处(图1)。每个IgG包含12个链内二硫键,每个二硫键都局限于一个单独的IgG结构域。不同亚型铰链区二硫键数量不同:IgG1有2个、IgG2有4个、IgG3有11个和IgG4有2个。IgG1的轻链与重链之间通过轻链的最后一个半胱氨酸残基和重链的第五个半胱氨酸残基之间的二硫键连接。然而,对于IgG2、IgG3和IgG4,轻链与重链之间通过轻链的最后一个半胱氨酸残基和重链的第三个半胱氨酸残基之间的二硫键连接。
链内和链间二硫键的溶剂暴露程度不同。形成链间二硫键的半胱氨酸残基位于铰链区(IgG2、IgG3和IgG4重链的第三个半胱氨酸残基除外,该残基位于VH和CH1结构域间),链间二硫键高度暴露在溶剂中。而链内二硫键位于各结构域内两层反平行的β-折叠结构之间,不暴露于溶剂。溶剂暴露的差异具有重要的意义,因为暴露的半胱氨酸残基被认为比不暴露的半胱氨酸残基更具反应性。
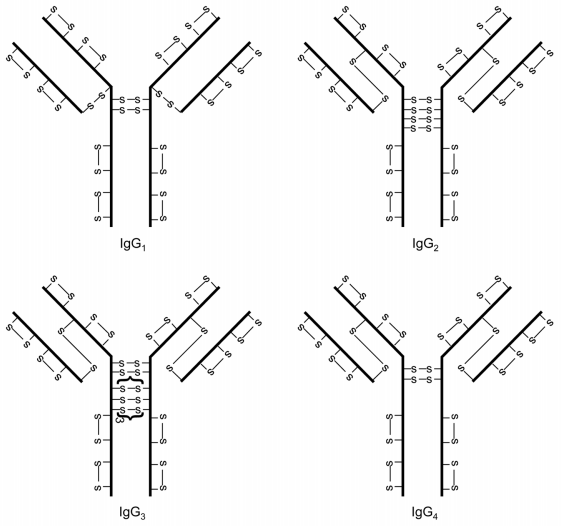
图1 IgG抗体四个亚型的经典二硫键结构
IgG经典二硫键结构以外的结构主要在IgG2和IgG4中被观察到。IgG1的重链间二硫键只有微量以链内形式存在的二硫键变体。IgG3铰链区有重复的氨基酸序列,共有11个二硫键紧挨着,没有多少形成二硫键变体的灵活性。
IgG2的非经典二硫键结构首先在重组单克隆抗体中被观察到,在人源IgG2分子中被证实。我们称经典二硫键结构IgG2A,两个主要的非经典结构IgG2B和IgG2-A/B,后者被认为是介于IgG2A和IgG2B之间的结构中间物(图2)。不同异构体的二硫键分布取决于轻链的类型,IgG22是λ轻链的主要形式;IgG2B是κ轻链的主要形式。在体外血清进行细胞培养的过程中,观察到IgG2A形式向IgG2B的转化。除了来自分子内二硫键连接的异构体外,二硫键连接的二聚体也在由细胞培养获得的重组IgG2和人血清中的IgG2中发现。
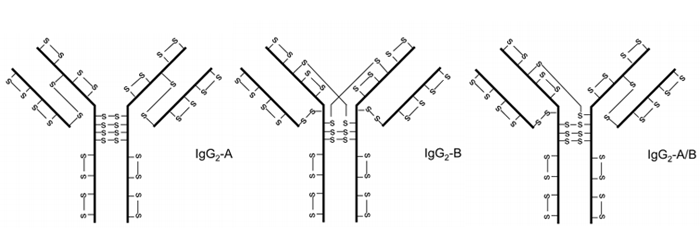
图2 IgG2三种二硫键结构
IgG中最被人熟知的非经典二硫键结构来自IgG4(图3)。非还原SDS-PAGE分析时,可以观察到大量的IgG4为半分子,但SEC分析中却没有观察到,这表明两个半分子是通过非共价相互作用。IgG1和IgG4铰链区有一个氨基酸有所差异:IgG1中有两个脯氨酸残基,IgG4中有一个丝氨酸和一个脯氨酸残基。用脯氨酸残基取代IgG4丝氨酸残基,重链间二硫键稳定性有所提升。由于IgG4重链间二硫键的不稳定性,可以在体外还原条件下获得双特异性抗体,也可以通过将等量的两个针对不同抗原重组IgG4抗体注射到免疫缺陷的小鼠体内获得。
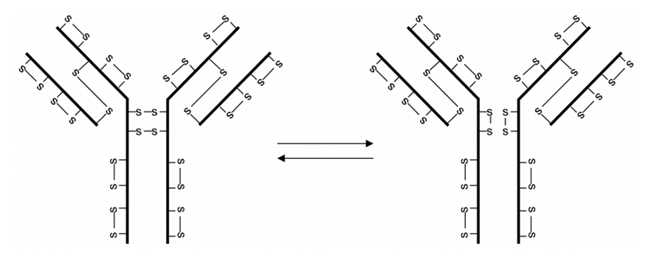
图3 IgG4两种二硫键结构
通常认为IgG中的所有半胱氨酸残基都处于二硫键的状态。实际上,游离巯基在IgG中常被检测到,包括来自血清中的IgG和重组IgG。表1中的两个发现值得讨论:首先,在变性条件下检测到的游离巯基水平更高。这表明,游离巯基与参与链间和链内二硫键的半胱氨酸残基有关。第二,在变性条件下,不同的研究中游离巯基的水平有很大的差异。这种巨大的差异可能是由多种因素造成的,包括不同的IgG类型(人源或重组)、不同的IgG亚型和实验条件变化。
表1 IgG中的游离巯基
| IgG类型 | 游离巯基/IgG | |
|---|---|---|
| 非变性状态 | 变性状态 | |
| 人源IgG2 | 0.24 | ND* |
| 人源IgG1 | 0.1-1.1 | 0.6-4.0 |
| 人源IgG1,IgG4,重组IgG4 | ND* | 0.9-2.2 |
| 重组IgG1,IgG2,IgG4 | 0.02-0.08 | 0.08-0.09 |
| 重组IgG1 | ND* | 0.64 |
| 重组IgG2 | 0.06 | 0.59 |
| 重组IgG2 | 0.158 | 0.379 |
ND*, not determined.
虽然IgG可能有不同程度的游离巯基,但研究表明,结构域中的游离巯基具有类似的分布,至少对于重组IgG1来说,分布类似。轻链可变区的游离巯基含量比恒定区的高。重链CH3结构域的游离巯基水平最高,其次是CH1、CH2和重链可变区。游离巯基的最低水平与链间二硫键有关,这表明游离巯基的低水平很可能是由于二硫键的不完全形成造成的。由于链间二硫键溶剂接触水平更高,故其比链内二硫键更容易降解,如果二硫键降解产生了游离巯基,预计与链间二硫键相关的游离巯基水平会更高。
上述以外的分布可能表明在特殊情况下,特定区域的二硫键不能有效地形成。到目前为止,文献中已经报道了两种特殊情况。在这两种情况下,重链可变区中的链内二硫键没有完全形成,以至于通过疏水作用或弱阳离子交换色谱法检测到了具有这种不完全二硫键的抗体。这种特殊的二硫键的完全形成可以通过在细胞培养中加入硫酸铜来实现,这说明细胞培养条件可以影响二硫键的形成。在血清中体外培养后的抗体或给药后从大鼠血清中重新获得的抗体显示不完全二硫键的形成显著减少。
在碱性条件下,二硫键可以通过β-消除机制分解,形成脱氢丙氨酸和过硫化物,后者可以恢复为半胱氨酸残基。IgG的轻链和重链之间的二硫键通过β-消除机制降解,随后产生的半胱氨酸和脱氢丙氨酸交联,导致了不可还原的硫醚键的形成。有研究发现硫醚键在4℃储存的重组单克隆IgG1中存在的量约占0.4%,在热应激的样品中则高达13.6%。脱氢丙氨酸的水解是除了肽键水解之外导致抗体铰链区分裂的另一个重要机制。
三硫键的形成是蛋白质的一种罕见的翻译后修饰,最早在重组单克隆IgG2中发现,四个重链间二硫键中的一个或两个可能以三硫键的形式存在。后来在重组IgG抗体的所有亚型中都检测到了三硫键,从来自骨髓瘤患者的人源IgG中也检测到了三硫键。通常重链和轻链间二硫键的半胱氨酸残基可以观察到更高水平的三硫键。重组单抗中的三硫键被认为是在发酵过程中,完整的二硫键与溶解的硫化氢(H2S)发生反应形成的。这一结论通过培养IgG与H2S产生了更高水平的三硫键得到了支持。在pH值为7.5的情况下,当重组的IgG2抗体与各种不同类型的抗体培养时,观察到三硫键向二硫键的大量转化。而在另一项研究中,人们发现三硫键在pH6.5的缓冲液和体外大鼠血清中是稳定的。然而,在腹腔注射大鼠血清24h后重新获得的重组IgG1中三硫键完全转化为二硫键。
非经典结构、游离巯基、三硫键等对抗体结构、稳定性和功能影响的信息有限,根据有限信息可以发现:
(1)IgG2B结构比IgG2A的更紧凑;IgG2A与IgG2B结合亲和力和生物活性相似,或IgG2A比IgG2B更高。
(2)对于IgG4的稳定性,用丝氨酸取代IgG4铰链区第一个的半胱氨酸,或用脯氨酸取代IgG4铰链区的丝氨酸,产生的突变抗体不影响抗原结合活性,且更稳定,并有可能增加半衰期。
(3)游离巯基对IgG的结构、稳定性和生物功能的影响:
a)没有完整链内二硫键的CL结构域、CH3结构域和单链可变区的个别结构域显示出较低的稳定性,但没有实质性的结构上的变化。
b)游离巯基的数量越多,重组抗体和人源IgG抗体的热稳定性就会越差。
c)与IgG1相比,IgG2具有更高的聚集倾向,这也是由于IgG2的游离巯基水平较高。
d)完整的二硫键并不是抗原结合的先决条件。但有研究指出,重组单克隆抗体的重链可变区中的二硫键形成不完全,导致效力显著下降。
异质性是重组单克隆抗体的共同特征,与二硫键结构相关的翻译后修饰和变体是异质性产生的潜在原因。研究表明,在抗体组装完成后,链内二硫键一般来说较为稳定。与这些链内二硫键相关的低水平的游离巯基可能是由于二硫键的形成不完全。另一方面,链间二硫键暴露且不稳定,这也会提高重组抗体的异质性。从理论上讲,非原生二硫键结构有可能引发免疫反应。因此,在重组单抗表达的过程中,应密切关注这些二硫键相关结构,并在未来研究中持续关注二硫键相关结构变体对重组抗体的稳定性、结构和生物功能的影响。
参考文献
Liu H, May K. Disulfide bond structures of IgG molecules: structural variations, chemical modifications and possible impacts to stability and biological function. MAbs. 2012;4(1):17-23.
 大分子生物药近年来迅猛发展,特别是抗体药物偶联物(antibody-drug conjugate,ADC)是药物市场增长最快的生物药之一,在肿瘤的靶向治疗中发挥着重要的作用。ADC药物主要由3个部分构成,即单克隆抗体、细胞毒性小分子药物(有效载荷)以及抗体-药物连接子。药物进入体内后,可特异性与肿瘤细胞上高表达的靶点受体结合,经内化后进入细胞,通过连接子的裂解或抗体的降解释放有效载荷,发挥细胞毒作用。对ADC药物在非临床和临床研发阶段药代动力学研究有助于准确全面评估ADC在体内的作用机制和生物过程,为ADC药物开发早期的选择与优化,以及后期用药的有效性和安全性提供依据。复杂的结构和作用机制给ADC药物药代动力学研究带来诸多挑战,主要体现在药代动力学特征、目标分析物质、生物分析方法和数据解释的复杂性和多样性。
大分子生物药近年来迅猛发展,特别是抗体药物偶联物(antibody-drug conjugate,ADC)是药物市场增长最快的生物药之一,在肿瘤的靶向治疗中发挥着重要的作用。ADC药物主要由3个部分构成,即单克隆抗体、细胞毒性小分子药物(有效载荷)以及抗体-药物连接子。药物进入体内后,可特异性与肿瘤细胞上高表达的靶点受体结合,经内化后进入细胞,通过连接子的裂解或抗体的降解释放有效载荷,发挥细胞毒作用。对ADC药物在非临床和临床研发阶段药代动力学研究有助于准确全面评估ADC在体内的作用机制和生物过程,为ADC药物开发早期的选择与优化,以及后期用药的有效性和安全性提供依据。复杂的结构和作用机制给ADC药物药代动力学研究带来诸多挑战,主要体现在药代动力学特征、目标分析物质、生物分析方法和数据解释的复杂性和多样性。
ADC药物的PK研究主要内容包括ADC的体外稳定性、血药浓度-时间曲线、吸收、分布、代谢及排泄(ADME)过程。
临床试验开展前,需在人和动物(药理试验和/或毒理试验动物)的血浆和/或全血等介质中考察ADC的体外稳定性。在进行此项研究时需根据ADC的裂解释放特征,选择合适的检测目标,如检测ADC的变化和/或游离小分子化合物的生成情况。
如果小分子药物是新化合物,建议综合应用体内外研究方法,定性和/或定量检测手段,对小分子药物的系统暴露量、血浆蛋白结合及排泄特征、肿瘤和正常组织的摄取/分布特征等进行详细研究。必要时,对小分子药物代谢产物进行系统暴露量、代谢产物谱、分布、脱落方式、断裂点等系统研究。可通过检测小分子药物的脱落量对ADC进行体外血浆稳定性和动物体内的代谢稳定性研究。另外,建议考虑连接子的稳定性对小分子药物非预期提前释放及其对药代和药效、毒性等的影响。
ADC由抗体和细胞毒性小分子载荷明显不同的两种组分组成。从分子量大小和空间体积来讲,抗体组分占ADC药物的绝大部分,因此抗体特性强烈影响着ADC的PK特征,如靶点介导的药物清除、FcRn介受体循环、Fc效应功能。同样地,ADC的吸收、分布、代谢和排泄(ADME)特征也与未偶联抗体特性相关,包括缓慢消除、长半衰期、低分布容积及蛋白水解介导的分解代谢。ADC还有很多特征明显不同于未偶联抗体,这是在ADC开发期间需要考虑的,包括结合和游离小分子载荷的组织分布,ADC小分子组分的偶联方式对代谢和生物转化的影响以及游离小分子与其他小分子药物的药物相互作用等。
表1 小分子药物、单抗、ADC的PK特征比较
| 性质 | 小分子药物 | 单抗 | ADC |
|---|---|---|---|
| 分子量 | 通常<1k | ~150k | ~150k |
| PK试验 | 小分子药物及其相关代谢产物 | 所有的抗体 | 偶联物、所有的抗体、以及未偶联细胞毒性药物 |
| 免疫原性 | 无 | 有 | 有 |
| 分布 | 高分布容积;宽范围;可能超过血液和良好灌注组织的实际体积 | 分布容积接近血浆体积,有限的组织分布 | 分布容积接近血浆体积,有限的组织分布 |
| 代谢 | Ⅰ相Ⅱ相代谢;CYP450代谢约为药物75% | 蛋白水解、胞吞、吞噬作用分解代谢 | 蛋白水解分解代谢和CYD450代谢组合 |
| 排泄 | 主要通过胆汁分泌和肾脏排泄 | 短肽和氨基酸重复使用,或通过肾小球过滤消除 | 小分子药物和单抗的组合 |
| 半衰期 | 短 | 长 | 长 |
| 清除 | 低剂量:线性 高剂量:非线性 |
低剂量:非线性 高剂量:线性 |
低剂量:非线性 高剂量:线性 |
常用于表征ADC PK特征的分析物包括:包括总抗体(偶联和未偶联抗体)、偶联抗体(偶联至少一个小分子载荷的抗体)、抗体偶联药物和游离(未偶联)药物。不同的分析物的PK所反映的内容和意义不同,整体上构成了ADC药物在体内的PK全貌。
表2汇总了各分析物的分析方法、测定对象及其生物学意义。对于不同的分析物对象,应选用适合的生物分析方法,这对准确评估ADC在体内的作用机制和生物过程具有重要意义。体内生物大分子的定量分析通常采用配体结合分析(Ligand-binding assays, LBA)方法,小分子药物通常采用LC-MS/MS方法。
表2 ADC PK研究的分析物、分析方法与生物学意义比较
| 分析物 | 分析方法 | 测定对象 | 生物学意义 |
|---|---|---|---|
| 总抗体 | LBA | ADC偶联与未偶联抗体 | 对ADC抗体相关PK行为的最佳评估方法 |
| 偶联抗体 | LBA | 与至少一个载荷偶联的抗体 | 估算活性ADC浓度,ADC PK分析的基础 |
| 偶联药物 | LBA或Affinity LC-MS/MS | 与抗体偶联载荷总量 | 估算抗体相关的活性药物,反应ADC从体循环的清除及抗体上药物的解离 |
| 游离药物 | LBA或LC-MS | ADC释放的游离载荷及代谢产物 | 最常见和最强效药物种类的理论评估,毒性评价的基础 |
| DAR值分布 | Affinity LC-MS 或Affinity HIC | DAR | 估算血浆/血清中的DAR值变化 |
| 抗药抗体(ATA) | LBA | 抗药抗体(ATA) | 评价免疫原性对安全性,PK/PD的影响 |
总抗体分析测定样品中所有的抗体,包括结合型的抗体(DAR≥1)和未结合的抗体(DAR=0),可以用于评估ADC是否符合单克隆抗体的一般PK特征。如果总抗体分析表明ADC快速清除,则提示ADC不能与靶标有效结合,不适用于后期开发。
对于总抗体,通常使用LBA平台进行分析:使用抗原ECD或抗独特型抗体捕获ADC,并由与ADC抗体部分的不同表位结合的另一种抗体进行检测,包括非阻断型抗独特型抗体或通用抗人IgG试剂。需要注意的是,无论哪种检测形式,须保证体内各DAR值ADC均能被准确检测。DAR值高的ADC可能会由于小分子药物的立体位阻效应,影响抗体与捕获试剂或检测试剂的结合。
偶联抗体即与小分子载荷偶联的抗体(DAR≥1),是ADC的PK研究中最重要的分析物。其浓度变化取决于两个过程:载荷从抗体上完全解离,即DAR变为0;抗体部分通过酶解等方式解体。
对于偶联抗体,通常使用LBA平台进行分析:使用抗小分子载荷的抗体作为捕获试剂,以标记的抗原ECD或者抗独特型抗体或抗人IgG Fc抗体作为检测试剂。
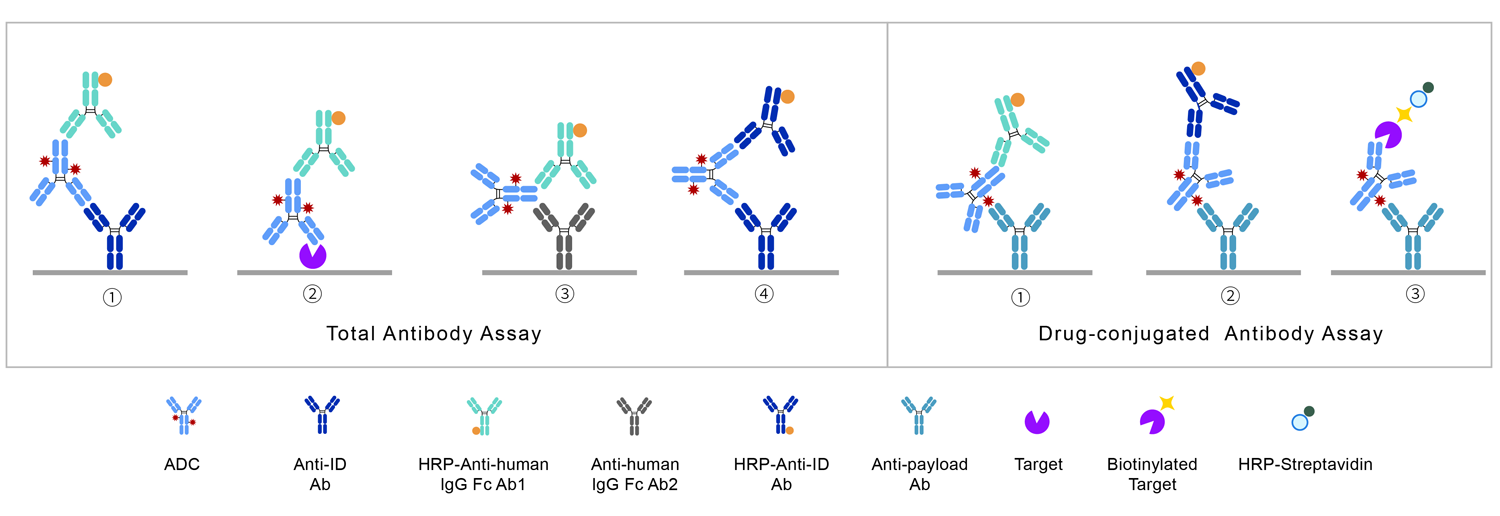
图1 总抗体/偶联抗体的LBA检测形式
偶联药物即所有偶联在抗体上的小分子载荷。偶联药物的浓度变化亦取决于两个同时进行的过程:载荷从抗体上完全解离;抗体部分通过酶降解等方式解体,此时载荷可能仍连接在抗体的碎片上,但这时已不能算作偶联药物。
偶联药物的测定可以采用LBA法,也可以采用亲和捕获LC-MS/MS法。LBA法测定选用抗原ECD、抗独特型抗体或抗人IgG抗体捕获ADC中的抗体部分,用抗小分子载荷的抗体作为检测试剂。亲和捕获LC-MS/MS法通常包含3步:①首先将ADC以某种方式(如蛋白A、抗独特型抗体、抗原等)捕获并与游离的小分子载荷分离;②以某种方法(化学反应或酶裂解)将小分子载荷从抗体上解离下来;③利用LC-MS/MS方法对解离下来的小分子进行定量。
游离药物即从抗体中解离下来的小分子载荷部分。游离药物的测定可以采用LC-MS/MS法或LBA法。通常认为LC-MS/MS更合适,因为其方法开发更简单,对这些结构类似的待测物特异性更强,在检测游离药物的同时,可以监测代谢产物的产生并对其定量。LBA法则需先利用乙腈沉淀去除蛋白,通过BSA-小分子载荷或抗小分子载荷的抗体包板,竞争法检测游离药物浓度。
ADC药物在体内随着小分子载荷的解离或不同DAR值ADC清除率的不同,其DAR值分布也在发生变化。研究DAR值分布有助于了解ADC药物在体内分解代谢过程,为ADC体内生物转化提供依据。常用测定血浆/血清样品DAR值分布的方法有亲和捕获LC-MS方法和亲和捕获疏水作用色谱(HIC)。这两种方法均可检测完整的分子量,用不同DAR值ADC去卷积化后的峰面积表征不同DAR值的相对丰度。
与其他大分子类似,ADC药物进入人体后,可诱导免疫反应,产生抗药抗体(anti-therapeutic antibody, ATA),导致ADC清除加快或药效降低,影响药物安全性、PK和药效。ATA有多种分析平台,包括桥连ELISA(bridging ELISA),药物用于捕获,标记的药物用于检测,电化学发光分析(ECL)、放射免疫沉淀法(RIP)、表面等离子共振(SPR)等,现在以桥连ELISA和ECL方法最为常用。
ADC的小分子组分与抗体的偶联方式可分为随机偶联和定点偶联,在使用随机偶联的情况下,不同数量的载荷连接至抗体的不同位点,形成不同DAR值的异构混合物。此外,ADC药物在体内经历复杂分解代谢和生物转化过程,导致ADC药物在体内具有异质性,存在着多种形式ADC分子。因此,构建合适的ADC生物分析方法需要考虑众多不同的因素。
(1)LBA方法具有高通量和高灵敏度等优势,是总抗体和偶联抗体定量的首选检测平台。理想状况下,采用的LBA方法对DAR的变化应不具有敏感性,但实际情况并非如此。可以认为,与ADC标准品的DAR相差程度越大的样品,其测得值的准确性越差。因此,构建总抗体和偶联抗体的分析方法时,需要考察DAR的变化对定量的影响。
(2)对于定量的分析方法要遵循等分子检测的原则,即在相同的分析条件下,一分子的标准品产生的检测信号与一分子的待测物产生的检测信号应该相同。如用于分析偶联抗体时,以靶标或者抗独特型抗体或者抗人IgG Fc抗体作为包被试剂,再以标记的抗小分子药物作为检测试剂。这种方法产生的结合信号除了反映ADC分子的数量外,还受到ADC分子中小分子数目的影响,该分析模式违反了等分子检测的原则,会导致药物偶联的抗体的检测不准确。
(3)ADC生物分析的挑战性同样源于与抗体偶联的小分子载荷的状态。ADC在体内经历的生物转化和分解代谢过程可能使ADC分子上的小分子载荷的结构发生改变,生成小分子载荷代谢产物。在此类情况下,构建偶联药物和游离药物的分析方法时,需要考察关键试剂与小分子载荷代谢转化后产物的结合情况。
(4)要了解各个关键试剂对不同状态下的ADC药物分子的结合反应性,基质中是否有游离靶标和结合蛋白的存在;并需要了解类似物与代谢物的情况,以及方法对抗药抗体的耐受程度等。
参考文献
[1]郭建军,高然,权腾飞,等.抗体偶联药物的药代动力学研究进展[J].药学学报,2015,50(10):1203-1209.
[2]秦秋平,陶亦敏,刘婷婷,等.ADC药物配体结合生物分析常见技术问题探讨[J].中国药物评价,2023,40(4):281-288.
[3]李秀立,陈笑艳,钟大放.抗体偶联药物研发中的生物分析[J].药学学报,2016,51(4):12.
[4] 季双敏,王玉珠,杨进波.抗体偶联药物的分子特点及其药代动力学研究考虑[J].中国临床药理学杂志,2021,37(6):6。
[5]于丝雨,刘晓东,刘李.抗体药物偶联物药动学研究进展[J].药学进展,2021,45(3):188-195.
 免疫原性(immunogenicity)是治疗性蛋白产品诱导机体产生免疫应答或诱导临床相关免疫不良反应的特性,可能影响药物代谢动力学、药效动力学、药物安全性和有效性。一般通过检测体液免疫产生的抗药抗体(anti-drug antibody,ADA)评价大分子药物的免疫原性。对于不同的产品,ADA的产生可能不会引起明显的临床后果,也可能导致严重的不良事件,如过敏反应、与内源性蛋白交叉反应、中和内源性蛋白导致其功能丧失等。中和抗体(neutralizing antibody,NAb)是一种特殊的ADA,NAb通过阻断产品到达其靶标或干扰受体/配体结合,从而干扰药物的体内活性。因此,NAb是抗药抗体免疫原性研究和评价的重要组成部分。
免疫原性(immunogenicity)是治疗性蛋白产品诱导机体产生免疫应答或诱导临床相关免疫不良反应的特性,可能影响药物代谢动力学、药效动力学、药物安全性和有效性。一般通过检测体液免疫产生的抗药抗体(anti-drug antibody,ADA)评价大分子药物的免疫原性。对于不同的产品,ADA的产生可能不会引起明显的临床后果,也可能导致严重的不良事件,如过敏反应、与内源性蛋白交叉反应、中和内源性蛋白导致其功能丧失等。中和抗体(neutralizing antibody,NAb)是一种特殊的ADA,NAb通过阻断产品到达其靶标或干扰受体/配体结合,从而干扰药物的体内活性。因此,NAb是抗药抗体免疫原性研究和评价的重要组成部分。
抗体药物偶联物(antibody-drug conjugates,ADC)是一类新兴的抗癌治疗药物,借助单克隆抗体的特异性,靶向运送细胞毒素到肿瘤部位,不仅可以提高化学治疗的疗效,而且可以降低或消除细胞毒素分子对非靶组织、非靶细胞的毒性。ADC药物的单克隆抗体、连接子、连接子-细胞毒素分子、偶联引入的新的抗原表位均可能具有免疫原性,这使得ADC药物诱导机体产生的免疫反应较为复杂;ADC药物结构和作用机制的特殊性决定了NAb的检测及评价也与抗体类药物具有不同之处,面临更大的困难和挑战。
治疗性蛋白药物的免疫原性评价多为定性或半定量的试验,通常采用多层次的分析策略。第1步为筛选试验,确定潜在的阳性样本。第2步为确证试验,确认抗体的药物特异性。确证试验一般在筛选试验的基础上,加入过量的药物竞争性结合ADA,通过响应信号的降低确证抗体的特异性。第3步为通过滴度试验、中和活性试验、抗体分型/亚型试验、表位分析(结构域分析)或亲和力检测等试验确定ADA的滴度、中和活性、亚型、表位和亲和力等特点,以便更好地分析可能出现异常的药动学、药效降低、过敏等不良反应事件发生等情况。
ADC药物作为特殊的生物大分子,其免疫原性评价同样遵循上述策略。鉴于ADC药物的结构特点,推荐增加表位分析试验,评价针对单克隆抗体、连接子、连接子-药物等不同表位ADA的产生及其影响。ADC药物没有对应的内源性成分,所以针对ADC药物的免疫反应不会中和重要的内源性蛋白。
目前,桥连试验基本可以检测绝大多数类型的ADA,因此基于桥连的酶联免疫试验(ELISA)或电化学发光试验(ECL)多用于大分子药物ADA的分析。ADC药物的抗药抗体表位分析可采用竞争法或直接检测的方法。竞争法表位分析的原理与确证试验类似,也是采用过量未标记的ADC与样本预先孵育,再进行检测。直接检测法则选用ADC作为捕获试剂,靶向单克隆抗体或细胞毒素分子的抗体作为检测试剂,直接检测ADA的表型。
中和活性检测方法的分析模式的选择需要基于多种因素进行考虑,包括但不限于药物本身的作用机制、检测方法与体内真实情况的相关性、方法本身的选择性、生物基质的干扰程度、灵敏度和稳健程度等。对分析模式进行选择时,建议将测定方法与药物体内作用机制的相关性作为首要考虑因素。常规用于抗体类药物中和抗体分析的试验模式(format)分别为:基于细胞的生物学试验(cell based assay)、非细胞的竞争性配体结合试验(non-cel lcompetitive ligand-binding assay,CLBA)。试验模式的选择应该考虑药物的作用机制(MOA),试验的灵敏度、选择性、精密度、药物耐受性及产生的NAb对受试者的影响等因素。中和抗体检测方法开发的目的是检测临床相关的NAb,检测性能是试验模式选择的关键因素。若已选择的试验假阴性/假阳性率较高且与临床结果一致性较差,应考虑提高方法的性能;若因技术限制无法达到预期的标准,则可以考虑选择性能更好的试验模式。
ADC药物的单克隆抗体和细胞毒素等不同结构域按照一定的顺序参与细胞杀伤效应,靶向单克隆抗体或细胞毒素的NAb可能阻断ADC药物的细胞杀伤活性,因此单独采用细胞增殖、凋亡等细胞功能性试验,可较好地反映ADC药物的作用机制,用于评价ADC药物产生ADA的中和活性。鉴于ADC药物的作用机制,FDA,EMA等监管机构首推基于细胞的生物活性试验用于ADC药物的中和抗体分析。
细胞增殖过程中代谢酶活性增加,而ADC药物作用后细胞死亡或凋亡,酶活性降低。首先,根据ADC药物的作用机制,选择合适的细胞系、检测系统,进而建立细胞活性、毒性检测系统,即药物的活性曲线。然后,根据药物的活性曲线,确定适当的ADC药物浓度,样本中存在的NAb可以降低ADC介导的细胞活性或增殖抑制。最后,根据一定浓度ADC药物作用后细胞活性的改变,判定NAb存在与否。
以活细胞线粒体脱氢酶为基础的细胞试验:CCK8,WST-8,MTT,XTT,MTS等试剂可以被活细胞线粒体脱氢酶还原为有色的甲臜,甲臜的吸光度值与活细胞的数量成正比,可以采用商品化的试剂盒分析细胞的增殖或凋亡,建立抗ADC药物抗体的中和活性分析方法。
以蛋白水解酶等为基础的细胞试验:细胞中的蛋白水解酶、烟酰胺腺嘌呤二核苷酸(NADH)等可用于定量分析活细胞、凋亡或死亡细胞,进而用于评价抗ADC药物抗体中和活性。多肽底物Gly-Phe-AFC可通过细胞膜,活细胞中蛋白水解酶可催化该底物产生可检测的荧光信号,根据此原理利用试剂盒检测活细胞的数量,可进而评价药物的活性。细胞死亡后释放蛋白水解酶,催化细胞非通透性底物bis-AAF-R110或AAF-aminoluciferin产生可检测的信号,通过释放的蛋白水解酶的催化活力评价药物的毒性。
细胞代谢的标志物,如三磷酸腺苷(ATP)、乳酸脱氢酶(LDH)等的浓度变化可作为检测指标用于评价细胞的活性。以细胞代谢物为检测指标的ADC药物活性分析方法,检测用药后代谢标志物水平的降低,降低程度与药物浓度呈正相关。样本中NAb与ADC的结合导致ADC药物活性降低,药物活性降低又引起代谢标志物水平的增加,增加程度与NAb的活性或浓度呈正相关。
基于细胞的中和抗体分析试验,通过ADC药物生物学活性被抑制评价抗药抗体的中和活性,比CLBA试验更能反映ADC药物体内发挥作用的情形。但细胞试验受基质或药物干扰较大,试验的灵敏度较低;样本的酸解处理可能会影响细胞的活性,因此在一些情况下,如经过充分的论证,也可考虑采用CLBA进行ADC抗药抗体中和活性分析。CLBA是基于NAb与药物靶蛋白竞争性结合药物,若样本中含有NAb,则表现为药物与靶蛋白的结合被一定程度抑制。CLBA试验系统通常较基于细胞的试验系统有更高的灵敏度、精密度,良好的药物耐受,还可耐受较强的基质干扰。
目前经FDA和EMA批准上市的Adcetris和Kadcyla以及部分处于临床研究的ADC药物,分别以ADC药物或BSA偶联的细胞毒素分子包被酶标板或电化学发光板,采用桥连等方式检测抗ADC药物或抗细胞毒素分子的抗体,评价抗药抗体的免疫原性。借鉴上述ADC药物ADA的分析方法,采用ADC药物或细胞毒素分子包被反应板,随后应用标记的抗原或抗细胞毒素分子抗体进行竞争性结合,从而评价ADA的中和活性,并检测抗药中和抗体识别的表位。
ADC药物中和抗体试验方法的开发存在的挑战包括:基于细胞的抗体难以区分抗体的表位、难以选择合适的阳性对照抗体、细胞系的变异较大、基质中的药物干扰较大等。
基于细胞的中和抗体分析试验,一般选择对药物较为敏感且能够耐受较高基质干扰的细胞系。但细胞经多次传代后,可能会丢失基因或改变基因型,研究人员应考察细胞系稳定的传代次数,降低试验的变异性。针对基质干扰,可在方法开发时确定最小稀释倍数,通过对样本的稀释,消除或降低基质的干扰。FDA推荐的最小稀释倍数为5~100倍,过大的稀释倍数可能导致假阴性结果的出现。
ADA可能包含靶向单克隆抗体、连接子、连接子-药物、新表位的中和抗体,而靶向不同表位的中和抗体可引起不同的细胞反应。针对单克隆抗体的NAb可阻断ADC药物与靶抗原的结合,导致受体介导的内化失败,表现为相较于药物对照组细胞活性升高。针对细胞毒素或连接子-细胞毒素的NAb内化进入靶细胞后,可能在溶酶体的特殊环境中被酸化、酶催化而释放细胞毒素,不影响细胞毒素发挥作用,表现为相较于药物对照组药物活性无改变。存在相反的情况,即针对细胞毒素或连接子-细胞毒素的中和抗体以免疫复合物的形式被内吞、进入溶酶体后仍可结合于细胞毒素分子上,从而抑制细胞毒素的杀伤效应,表现为相较于药物对照组细胞活性升高,与第一种情况相似。NAb具有结合游离细胞毒素和ADC药物各功能域的能力,导致非靶组织因发挥免疫复合物清除功能摄取免疫复合物而中毒。因此,基于细胞的抗ADC药物中和活性分析不能检测到所有类型的中和抗体,可能低估中和抗体的存在。
中和抗体检测结果高度依赖于试验的灵敏度和特异性,高灵敏度、特异性、选择性的试验方法则高度依赖于阳性对照抗体的选择。来源于抗药中和抗体阳性受试者的抗体是阳性对照抗体的最佳选择,但是获得足够的此类阳性对照抗体非常困难,因此分析方法开发和验证过程中使用的阳性对照抗体多数来源于实验动物,如兔、小鼠等。目前,多采用药物免疫试验动物,获得抗独特型的多克隆抗体或单克隆抗体作为阳性对照抗体。同一种试验方法,采用较高亲和力的阳性对照抗体可获得较高的灵敏度、相对较好的选择性和特异性。德泰生物抗独特型多/单克隆抗体制备服务,抗体亲和力高,特异性好,保证下游试剂盒开发灵敏度,为生物药研发解除限速。
ADC药物为多结构域药物,各结构域均可能引起机体的免疫反应。制备针对ADC整个药物或单抗的阳性对照抗体较为容易,而制备针对细胞毒素小分子、连接子-细胞毒素分子等半抗原的具有中和活性、高亲和力的阳性对照抗体则存在较大挑战。德泰生物小分子抗体制备服务,从半抗原改造、半抗原载体偶联、动物免疫、抗体筛选与功能验证到抗体生产纯化的一站式服务;服务基于SingleB®快速单抗发现平台,筛选通量大,获得的抗体亲和力更高,检测灵敏度更佳。此外,ADC药物在连接后可能形成新的免疫原性表位,由于缺乏对这类表位的了解,因而制备针对此类抗原抗体的难度很大。鉴于此,几乎不可能实现表位特异的抗药抗体中和活性分析。
由于阳性对照抗体来源于动物,所以真实样本的中和抗体谱与阳性对照抗体存在差异,阳性对照抗体的中和活性并不能代表真实的NAb中和活性。因此,采用阳性对照抗体建立的试验方法的灵敏度、耐药性等参数仅能作为参考。
CLBA试验采用靶蛋白与NAb竞争性结合药物的原理对中和抗体进行分析评价。靶蛋白的纯度以及与内源性蛋白性质的相似性是影响试验参数的重要因素。基于检测原理及样本处理的需要,对ADC药物进行生物素、Sulfo-tag等标记时需考虑下列问题:(1)标记位点被连接子占据致使标记效率低或标记失败;(2)标记导致ADC的聚合倾向性增加,降低ADC的稳定性和免疫学活性;(3)高比率的标记可能掩盖ADA和NAb的识别表位。
机体循环系统中往往既含有游离药物、游离ADA,又含有药物-ADA免疫复合物。基质中游离药物对免疫原性检测往往产生干扰,而ADA-药物免疫复合物的存在则导致NAb漏检率增加。长期、多次给药后,样本中通常存在高浓度的游离药物或药物-ADA免疫复合物,导致假阴性率明显增加。由于阳性对照抗体的性质、试验设计、药物浓度等因素都对试验方法的耐药性存在一定影响,因此不可能确定多种因素下的药物耐受水平。通过在消除相采集样本或酸解处理样本,在某种程度上可增加检测的准确性和提高药物耐受水平。但ADC药物给药后样本酸解处理需注意下列问题:(1)采用酸敏感连接子制备的ADC不能进行酸解处理;(2)方法中采用的阳性对照抗体和样本中真实NAb的酸敏感性不同,检测的不确定性增加。(3)经酸解、中和后的样本溶液,可能会改变细胞培养基的渗透压或pH,不利于细胞生存,继而导致非药物作用的细胞死亡,使试验结果的假阳性率增加。
基质中可能存在的游离靶点可与NAb竞争性结合药物,发挥与中和抗体相同的降低药物活性的作用。个体基质中的游离靶点可因不同季节,受试者或患者患病状态、年龄、性别等因素有较大水平的波动,因此方法学验证时应考虑游离靶点对确定临界值产生的干扰。同理,样本检测中也应考虑样本中不同浓度的游离靶点可能导致假阳性率增加。此时,可考虑增加样本处理步骤,清除基质中游离靶点,降低或清除靶点干扰。
ADC药物因其高特异性的靶向治疗受到越来越多的关注。随着ADC药物的增多,积累的ADC药物免疫原性评价的经验可用于评估采用同样连接子、细胞毒素分子和同样药物-抗体比率连接的ADC药物的临床免疫原性风险,判读ADA和NAb产生的趋势以及预测ADA和NAb识别的表位。同时也应认识到,每种ADC药物的免疫原性风险与其采用的单克隆抗体、连接子、细胞毒素及其裂解方式、受试者免疫状态等因素有很大关系,单个ADC药物的免疫原性评价方法和结果仅作为该类药物免疫原性检测方法设计和开发时的借鉴,尚不能为其他ADC药物免疫原性风险评估策略的制定提供直接参考。因此,必须评估每种ADC药物的免疫原性风险,加强对检测方法的开发和优化,指导药物研发,增加用药安全性。此外,ADC药物靶向运送细胞毒素的特性,启发新的结合性靶向治疗大分子的产生,如靶向传染性病原体的抗体-抗生素结合物、靶向炎症的抗体-糖皮质激素结合物等,这也将为ADC药物免疫原性评价带来新的挑战。
参考文献
[1]宫新江,满素勤,邵雪,等.抗体药物偶联物抗药抗体中和活性分析研究进展[J].中国新药杂志, 2019, 28(21):2573-2580.
在过去十年,第一代和第二代抗体药物偶联物(ADC)的经验为第三代ADC的发展铺平了道路。与第二代ADC相比,第三代ADC具有更优的连接子和偶联机制,因此具有更宽的治疗窗口。同时,第三代ADC多选择可以靶向整个细胞周期的DNA/RNA抑制剂作为有效载荷。
与微管蛋白抑制剂相比,DNA抑制剂可以通过双链断裂、烷基化/交联、嵌入等方式破坏DNA,可以作用于细胞的整个生命周期,引起细胞毒性,对实体瘤有良好的治疗效果。DNA抑制剂的靶点远少于微管蛋白抑制剂,当ADC携带相同数量的有效载荷进入细胞时,DNA抑制剂可以表现出更好的杀伤效果。以DNA抑制剂为有效载荷的ADC还可以靶向抗原表达低的肿瘤细胞,这解释了为什么DNA抑制剂在许多下一代ADC中被选为有效载荷。
拓扑异构酶Ⅰ(TopⅠ)是保证基因组稳定性和DNA结构的重要核酶,已成为ADC的热门靶标。肿瘤细胞中TopⅠ含量及活性远高于正常体细胞,抑制TopⅠ-DNA可裂解复合物解离,就能选择性抑制肿瘤细胞的快速增殖,进而杀死肿瘤细胞。TopⅠ已成为公认的抗癌药作用靶点。
TopⅠ抑制剂可分为两大类:TopⅠ毒剂和TopⅠ阻遏剂。两者都抑制活性,使DNA不能松弛,但又存在区别。TopⅠ毒剂捕获TopⅠ-DNA可裂解复合物,形成“路障”,使复制不能进行,从而导致细胞死亡,而非仅通过抑制酶催化活性杀死细胞。肿瘤细胞对TopⅠ毒剂的敏感性随TopⅠ过表达而增加,同时,TopⅠ的活性下降通常会导致TopⅠ毒剂耐受性的产生。TopⅠ阻遏剂则相反,它通过抑制酶的催化活性而杀死细胞,因此它们在TopⅠ低表达的细胞中活性更好。两类抑制剂在抗肿瘤治疗中各有优势。
目前已在临床使用或处在研发阶段的以拓扑异构酶Ⅰ为有效载荷的ADC药物主要使用的是喜树碱(CPT)及其类似物。CPT最早于1966年从我国产珙桐科植物喜树中分离得到,是一类具有五环结构的生物碱。CPT属于TopⅠ毒剂,通过与TopⅠ、DNA结合形成稳定的复合物,诱导S期细胞中的双链DNA断裂,从而导致细胞凋亡(图1)。然而,CPT极低的溶解度阻止了其作为癌症治疗药物的广泛使用,故改造重点放在改善喜树碱理化性质、提高其内酯环稳定性等方面。近年来已合成了一系列喜树碱类似物,如已上市的10-羟基喜树碱(HCPT)、拓扑替康(Topotecan,TPT,图2)、伊立替康(Irinotecan,CPT-11)和贝洛替康(Belotecan,BLT)。
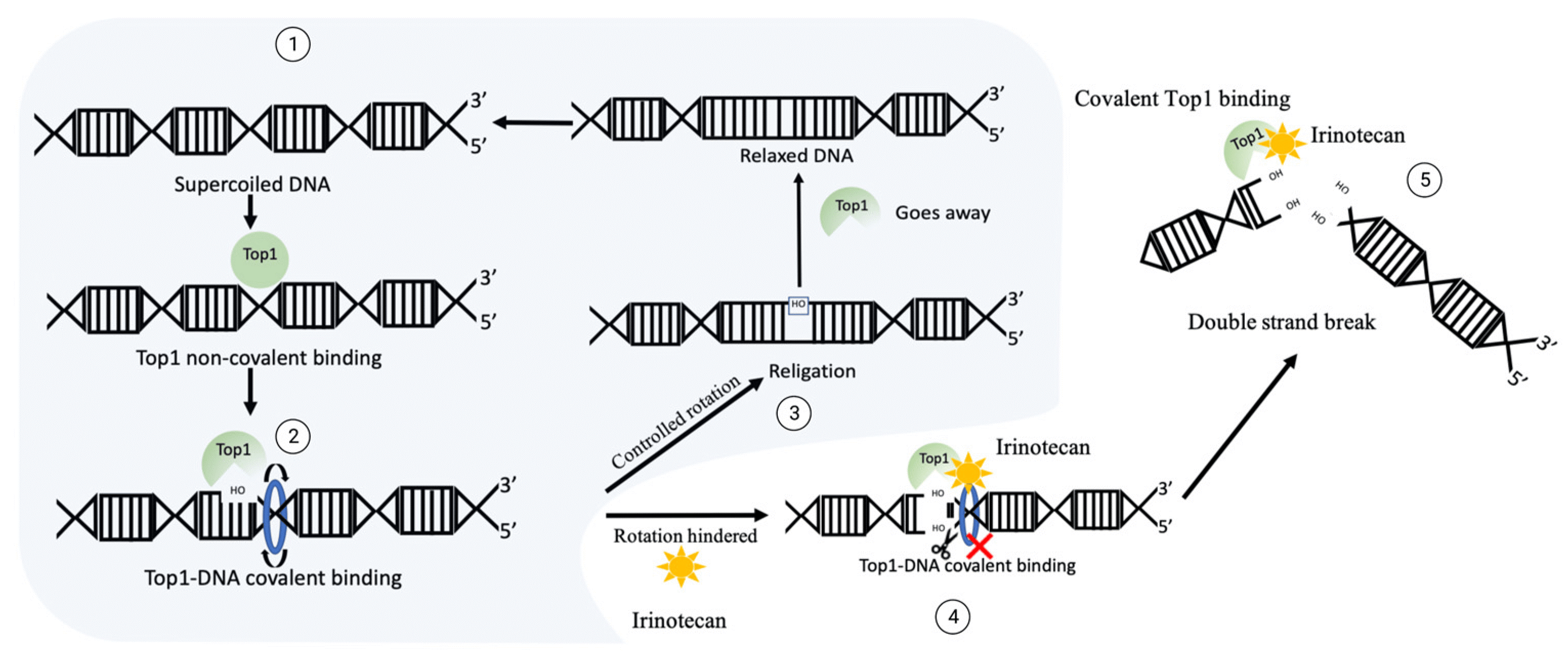
图1 喜树碱类毒素CPT-11暴露情况下DNA断裂机制
正常情况下TopⅠ的作用机制①TopⅠ感应超螺旋并形成切口使得②DNA松弛③TopⅠ重新连接切口并离开位点。
在CPT-11暴露的情况下,TopⅠ与DNA共价交联④3′端游离-OH的连接被阻断,并转化为⑤双链断裂并促进细胞毒性。
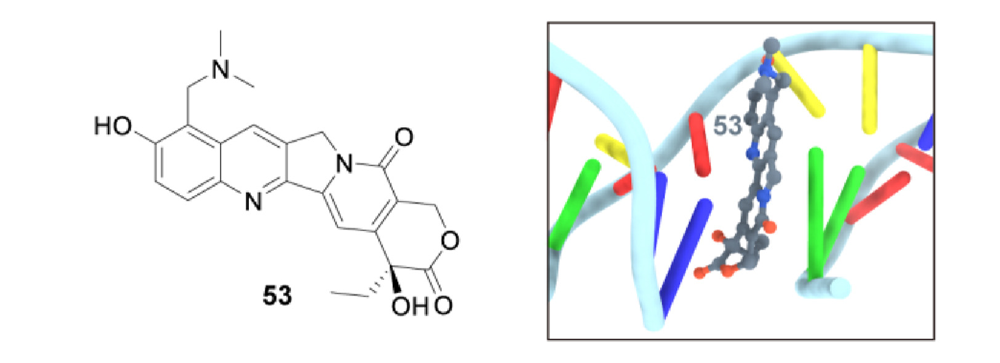
图2 拓扑替康结构及与TopⅠ-DNA复合物结合模式图
拓扑替康与DNA间为堆积作用,与TopⅠ的Asp-533以氢键结合,与磷酸酪氨酸和Asn-722之间的活性位点以水桥形式相互作用。
SN-38是CPT-11的活性代谢产物,CPT-11 C10位双哌啶基侧链的氨基甲酸酯键可被肝脏中的羧酸酯酶裂解,从而产生SN-38(图3)。对CPT-11和SN-38构效关系进行研究发现:(1)C10位以-OH取代的喜树碱是高效低毒化合物;(2)A环用较大基团取代后活性降低;(3)A和B环的刚性平面结构对喜树碱生物活性有重要影响,可使活性增强;(4)C5位以-OH,-OCOCH3和-C2H5等取代后活性完全消失,可能是位阻增加,阻碍B环DNA-酶复合物嵌合;(5)C7和C9位为极性取代基时,可使活性增强;C7位以乙基取代活性最强;(6)C20位羟基必须为α位,为药物活性必需基团;(7)完整的内酯环(E环)或酯基是维持药物活性的重要基团;(8)在C9、C10、C11位加上亲水性羟基、硝基基团可以增加药物的水溶性。
SN-38对几种不同来源的人类癌细胞系的IC50约在1.0~6.0 nM范围内。在体内生理pH条件下,SN-38会因pH微弱升高打开作为主要活性基团的内酯环,从活性较强的内酯环形式水解成活性较低的羧酸盐形式,导致效力降低;C10位会快速通过UGT-1A(尿苷二磷酸葡萄糖醛酸基转移酶)被葡萄糖醛酸化。
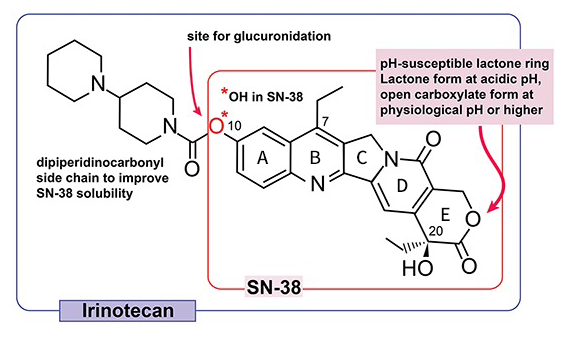
图3 CPT-11、SN-38化学结构图
Trodelvy®是由Immunomedics研发一款靶向Trop-2 ADC药物,于2020年4月FDA获批上市。Trodelvy®通过CL2A连接子将靶向癌细胞表面Trop-2的人源化单克隆抗体hRS7和与SN-38偶联,平均DAR为7.6,具有旁观者杀伤效应。CL2A连接子具有短的PEG(聚乙二醇)残基增加溶解度,减少聚合的可能;加入马来酰亚胺基团,使连接子-有效载荷复合物与抗体上产生的巯基反应,形成稳定的硫醚键。CL2A和SN-38通过pH敏感的碳酸苄酯键结合,在低pH环境中(肿瘤的微环境)SN-38可以从连接子中释放。目前,Trodelvy®全球获批适应症包括局部晚期或转移性乳腺癌及局部晚期或转移性尿路上皮癌。

图4 Trodelvy®结构示意图
依喜替康甲磺酸盐(Exatecan mesilate, DX-8951f)是一种水溶性CPT衍生物,与其他CPT类似物相比,具有更强Top-Ⅰ抑制和抗肿瘤活性。DXd为依喜替康衍生物,具有高膜渗透性,IC50 2.05~17.8 nM,可克服P-糖蛋白介导的多药耐药性,对各种肿瘤移植模型(包括体内CPT-11耐药肿瘤)具有更强的疗效。
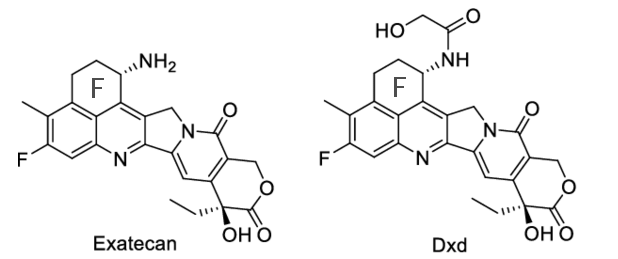
图5 Exatecan、DXd化学结构图
Exatecan有一个F环,其中包含第二个手性中心,使其合成和衍生化复杂化。构效关系研究表明,C11位的氟取代通常会使细胞毒性增加数倍,并且C20中心必须处于S构型才能使分子保持活性。其内酯环稳定性的提高归因于C11氟取代基和F环的作用。
在链霉菌中发现的吡咯并[2,1-c][1,4]苯二氮卓类(PBD)是一类具有抗肿瘤活性的天然产物,通过鸟嘌呤与PBD的亲电性N10/C11亚胺形成共价键,将DNA小沟选择性烷基化,导致DNA链间交联,使细胞周期停滞在G2/M期,引起细胞凋亡。
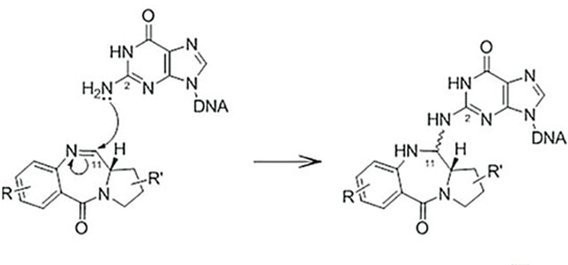
图6 PBD与DNA共价结合的机制
PBD二聚体具有用作有效载荷的潜力,其与DNA形成的链间交联的扭曲最小,可以有效逃避DNA的修复机制,使其在细胞中保持持久且较高的生物活性。PBD二聚体对各种癌细胞类型表现出皮摩尔范围内的细胞毒性,属于高毒素有效载荷,一般选择搭配较低DAR值(通常在2左右)。这种强效力提供了靶向低拷贝数抗原的能力,这对实体瘤的治疗特别重要。其次,PBD二聚体具有较好的膜通透性,已被证明在体外/体内均可以产生有效的旁观者杀伤效应。PBD二聚体的半衰期非常短,这确保了游离药物的脱靶毒性在全身的蓄积受到限制。许多有效的PBD二聚体载荷不是显著的P-糖蛋白底物,这使它们较长春碱类、紫杉烷类、蒽环类、拓扑异构酶抑制剂等P-糖蛋白底物具有重要的优势。除以上优势以外,PBD二聚体还拥有较为简单的合成途径。
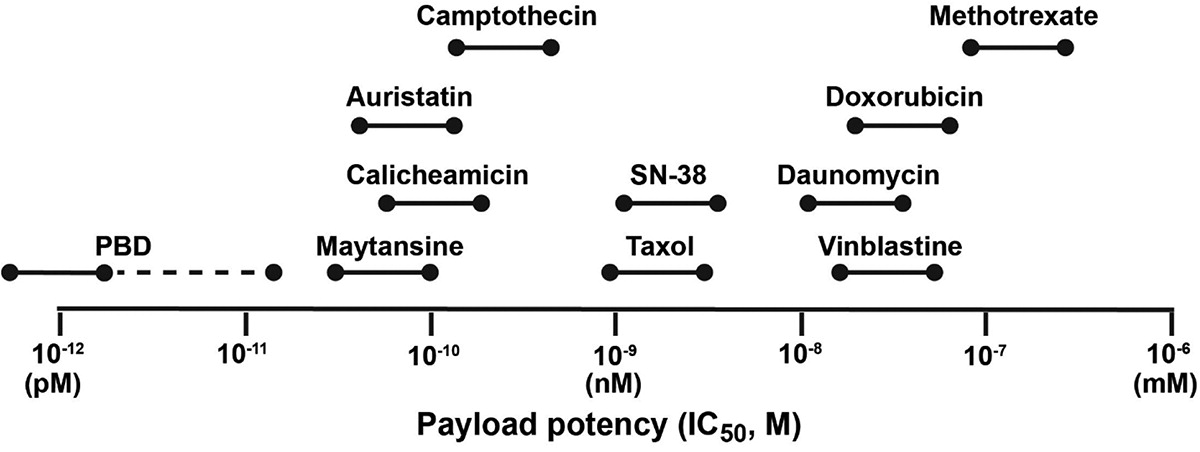
图7 各类有效载荷IC50一览
ZynlontaTM由ADC Therapeutics研发的靶向CD19 ADC药物,于2021年4月获FDA加速批准上市,用以治疗复发性或难治性弥漫性大B细胞淋巴瘤(r/r DLBCL)。由靶向CD19的人源化IgG1ҡ单克隆抗体通过马来酰亚胺连接子偶联到Tesirine(SG3249),Tesirine由8个聚乙二醇(PEG8)、组织蛋白酶B可裂解的Val-Ala连接子以及PABA间隔子组成,可释放PBD二聚体有效载荷SG3199。
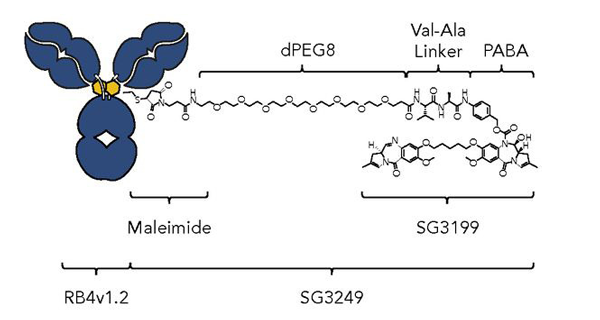
图8 ZynlontaTM结构示意图
CS5001是以PBD为前药(pPBD)设计的靶向ROR1 ADC药物,在多种表达ROR1的肿瘤细胞系中显示出很强的选择性,并在血液和实体瘤异种移植小鼠模型中显示出显著的体内抗肿瘤活性。临床试验目前正在进行中。
ADC领域的一个明显趋势在于适应症正从血液瘤转向实体瘤,这种趋势可能使对有效载荷的选择从靶向微管抑制剂转向靶向DNA损伤剂。后者通常表现出更高的效力,能满足新一代ADC药物所需的治疗指数。此外,使用DNA损伤剂作为有效载荷,可以选择表达水平相对较低的肿瘤特异性/相关表面受体。使用DNA损伤剂作为ADC有效载荷的技术已经相对成熟,然而DNA损伤难以修复,对其带来的毒副作用也应相对慎重。目前,只有一种以DNA损伤剂为有效载荷的ADC药物在临床上使用。未来,针对安全性/耐药性问题仍需进一步研究。
以上载荷对部分肿瘤仍无法产生抑制作用,或易产生耐药性。生长缓慢的肿瘤细胞通常不像快速分裂的那样依赖微管蛋白介导的细胞过程。因此,为了进一步扩大ADC有效载荷的范围,确定对快速/慢速增殖细胞均有效并能逃避多药耐药性的有效载荷,人们的注意力转向了靶向RNA的有效载荷。靶向RNA的小分子抑制剂可以同时作用于分裂期和休眠期的肿瘤细胞,有望解决由于肿瘤细胞休眠引起的肿瘤耐药性和复发扩散的问题。目前有两种主要类型的RNA抑制剂可用于ADC有效载荷:RNA剪接抑制剂(泰兰斯他汀及其类似物)和RNA聚合酶Ⅱ抑制剂(鹅膏毒肽)。
RNA剪接通过剪接内含子和外显子将RNA转化为mRNA来控制代谢、血管生成、癌细胞增殖和转移。它可以直接控制转录的起始、延伸和终止,可以作为癌症抑制的生物学靶点。研究发现,在RNA剪接调节药物的干扰下,肿瘤细胞可以产生新抗原,通过MHCⅠ呈递为新抗原表位,从而刺激抗肿瘤免疫。RNA剪接调控可作为肿瘤抗原的潜在来源,具有应用于肿瘤免疫检查点治疗的潜力。
泰兰斯他汀是一种从布鲁氏菌中分离出来的天然产物,通过与剪接体U2-snRNA亚复合物SF3b结合而激活。泰兰斯他汀家族通过抑制真核mRNA剪接途径,对剪接体具有很强的结合和抑制作用,对多种癌细胞系的IC50处于低纳摩尔,有潜力用作ADC药物的有效载荷。
辉瑞曾探索使用泰兰斯他汀及其类似物作为抗体药物偶联物有效载荷,将含羧酸的泰兰斯他汀半合成类似物直接偶联至曲妥珠单抗表面赖氨酸。该ADC对HER2高表达胃癌细胞系N87和MDR1过表达细胞系有效,且在低至1.5mg/kg的剂量下,对胃癌异种移植模型也能产生优于临床批准的T-DM1的效力。
鹅膏毒肽是一类双环八肽毒素,属于真核RNA聚合酶Ⅱ(RNAPⅡ)的选择性抑制剂,可导致细胞凋亡。鹅膏毒肽中研究最为深入的是α-鹅膏蕈碱(α-amanitin),这种毒素具有突破耐药性、破坏沉默期肿瘤细胞的潜力,可以有效防止肿瘤转移和复发。对α-鹅膏蕈碱晶体结构的研究发现,抑制剂的位置与桥螺旋(bridge helix)相邻,启动环主要处于远离加成位点的稳定构象中(图9)。α-鹅膏蕈碱环肽骨架形成一个口袋,允许与RNAPⅡ亚单位Rpb1 His1085侧链咪唑环形成特异性互补氢键,从而对启动环产生了一个约束位点。α-鹅膏蕈碱对咪唑的特异性主要通过Gly7的酰胺NH与Rpb1 His1085 N(D1)和Asn1的羰基与Rpb1 His1085 NH(E2)的相互作用来实现。
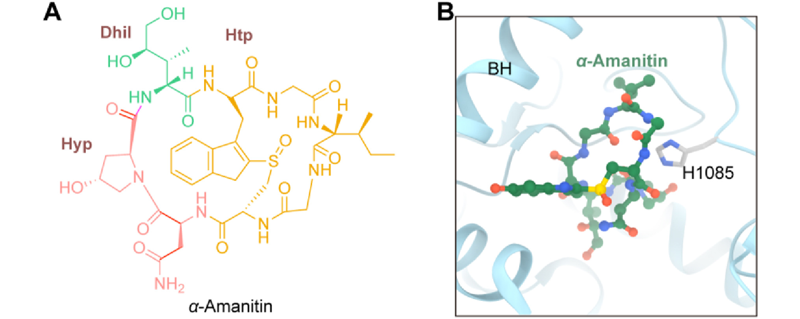
图9 α-鹅膏蕈碱结构及与RNA结合模式图
由于鹅膏毒肽分子量小、水溶性好、非P-糖蛋白底物以及对RNAPⅡ的抑制作用,近年来作为有效载荷在癌症研究中受到越来越多的关注。HDP-101是德国Heidelberg Pharma开发的以鹅膏毒肽为有效载荷的,靶向B细胞成熟抗原(BCMA)ADC药物,目前正处于Ⅰ/Ⅱa期临床试验中,用于治疗复发/难治性多发性骨髓瘤。
以泰兰斯他汀和鹅膏毒肽为有效载荷的ADC药物能够避免治疗耐药性,对休眠的肿瘤细胞也产生作用,现有的标准疗法很少能达到这种效果。虽然暂时没有使用靶向RNA有效载荷的ADC药物上市,但它们的巨大潜力值得进一步探究。
参考文献
[1]Wang ZJ, Li HX, Gou LT, et al. Antibody-drug conjugates: Recent advances in payloads[J]. Acta Pharm Sin B, 2023, 13(10): 4025-4059. doi: 10.1016/j.apsb.2023.06.015.
[2]Kumar S, Sherman M Y. Resistance to TOP-1 Inhibitors: Good Old Drugs Still Can Surprise Us[J]. Int. J. Mol. Sci, 2023, 24: 7233.
[3]Goldenberg DM, Cardillo TM, Govindan SV, et al. Trop-2 is a novel target for solid cancer therapy with sacituzumab govitecan (IMMU-132), an antibody-drug conjugate (ADC)[J]. Oncotarget, 2015, 6(26): 22496-22512.
[4]王丽焱.抗肿瘤药伊立替康的研究进展[J].国外医学药学分册, 2004.
[5]Goldenberg DM, Sharkey RM. Antibody-drug conjugates targeting TROP-2 and incorporating SN-38: A case study of anti-TROP-2 sacituzumab govitecan[J]. mAbs, 2019, 11(6): 987–995.
[6]Mantaj J, Jackson PJ, Rahman KM, et al. From Anthramycin to Pyrrolobenzodiazepine (PBD)-Containing Antibody-Drug Conjugates (ADCs). Angew Chem Int Ed Engl. 2017, 56(2):462-488.
[7]Hartley JA. Antibody-drug conjugates (ADCs) delivering pyrrolobenzodiazepine (PBD) dimers for cancer therapy[J]. Expert Opin Biol Ther, 2021, 21(7):931-943.
[8]Zammarchi F, Corbett S, Adams L, et al. ADCT-402, a PBD dimer-containing antibody drug conjugate targeting CD19-expressing malignancies[J]. Blood, 2018, 131(10):1094-1105.
[9]https://mp.weixin.qq.com/s/Os3fgrcjy0W1dGP2uTLASw
本指导原则中,药物的免疫原性是指药物和/或其代谢物诱发对自身或相关蛋白的免疫应答或免疫相关事件的能力。免疫反应的影响广泛,从无临床意义抗药抗体的暂时出现,到严重危及生命。不必要或非预期的免疫反应可能导致中和药物的生物学活性,或与对应的内源性蛋白产生交叉免疫反应,也可能导致过敏反应和细胞因子释放综合征等不良事件的发生,对患者的安全和药物的有效性均有重要影响。
对于大多数药物,不良免疫反应一般由体液免疫机制介导的免疫应答所致,因此抗药抗体一直是定义该类药物免疫原性的主要标准。但近年来随着免疫调节类药物在重大疾病中更加广泛的应用,细胞免疫机制介导的不良免疫反应也应得到重视。药物的免疫原性受到多种因素的影响,患者自身和药物相关因素均可能影响药物的免疫原性。患者和疾病相关因素包括患者的免疫状态和免疫能力、遗传因素、预存抗体、给药途径、剂量和频率等。药物相关因素包括产品来源、结构、聚合物的形成、糖基化、聚乙二醇化、杂质、处方、包装和储存等。药物开发的全生命周期中应始终关注免疫原性研究,基于药物作用机制,产品相关因素,以及拟用适应证等因素预测免疫原性风险,基于免疫原性风险设计相应的研究进行风险识别。在药物的开发中,一方面应尽量选择免疫原性潜在风险较小的候选药物,另一方面应探索如何减少和控制免疫原性的不良影响。
本指导原则适用于治疗性蛋白质、多肽及其衍生物,以及含有此类组分的药物,例如抗体偶联药物。其他具有潜在免疫原性风险的药物也可参考本指导原则。
免疫原性研究主要聚焦在抗药抗体的检测和表征上,通常应获得抗药抗体的发生率、滴度、存续时间和中和能力数据。有些情况下,需要对抗药抗体进一步表征,如同种型和亚型或者与相关内源性蛋白的交叉反应性。应始终考察抗药抗体生成与药代/药效动力学、疗效、以及安全性之间的相关性。免疫原性风险识别中,细胞介导的免疫反应也很重要,应在适用的情况下考虑对其进行评估。如果观察到临床相关的免疫反应,应对其潜在机制进行研究,并确定关键的影响因素。这些研究有助于控制和缓解策略的制定和实施,包括修改产品处方和筛查高风险患者人群。
治疗性蛋白药物通常具有种属差异,基于动物免疫原性研究结果预测人体免疫原性具有局限性。但是,在非临床研究中进行免疫原性评价仍然具有一定意义。免疫原性相关反应可导致非临床研究结果复杂化并难以解释,免疫原性数据有助于安全性数据的整体分析,因此免疫原性研究始终是治疗性蛋白药物非临床安全性研究证据链的重要组成部分。应考虑将新技术(新兴的生物信息学、体外和体内模型)用于开发过程中。对于细胞因子释放综合征、自身免疫反应等免疫相关不良反应,应在药物的开发早期进行风险评估。对于具有潜在风险的药物,除了在常规的动物体内毒性试验中进行细胞因子相关检测外,应进行体外细胞因子释放试验(具体试验方法见附录三)。当治疗性蛋白药物对应的内源蛋白具有不可替代的生理功能时,应充分评估潜在自身免疫反应介导的安全性风险。通常基于对内源性蛋白生理功能的已有认知,安全性风险是可以预估的,因此不必为了确定这些安全性风险而专门进行动物试验。但是,如果缺乏足够认知,并且理论上提示存在安全性风险,则应考虑对治疗性蛋白药物(或针对动物的替代分子)进行动物免疫试验,以便于了解不良免疫反应的潜在影响。
生物类似药开发时需要进行免疫原性比较试验,生物类似药和参照药应采用同样的分析模式和采样计划。分析方法最好能同时检测生物类似药和参照药的抗药抗体,至少应尽可能检测到生物类似药的所有抗药抗体。无论采用单一分析方法还是两套分析方法,均应进行相应的交叉验证,以期获得对生物类似药和参照药同样的检测性能。通常,应对抗药抗体生成和性质进行检测,并应评估和解释对临床有效性和安全性指标的潜在影响。
当生产工艺变更需要临床试验支持时,免疫原性的研究应与药代动力学、安全性和有效性试验相结合,应优先开展变更前后药物的头对头试验。
免疫原性研究涉及多学科及不同研发阶段,免疫原性相关数据往往分散在上市申请的多个部分。建议对免疫原性研究结果进行综合概述,并将其放于CTD2.7.2.4特殊研究中,总结应简明扼要,并包含详细研究报告的链接。
制定与预期治疗计划相关的综合分析策略对于阐明免疫原性数据的临床相关性至关重要。考虑到与临床安全性和疗效的相关性,免疫原性研究通常集中在对抗药抗体的检测和表征研究上。抗药抗体检测需要进行谨慎且前瞻性的设计和计划,包括分析方法的选择和开发、合适的采样点、充足的采样体积、样本采集的流程及储存方法、以及数据分析选用的统计学方法。
(一)试验设计考虑
1.检测策略
抗药抗体的检测通常应采用多层级分析方法,首先对所有样本进行筛选试验,之后对疑似抗体阳性样本的特异性进行确证试验,对已确证抗体阳性的样本进行滴度试验,以及对抗体中和活性进行检测。其中在已确证抗体阳性的样本中,有时还应考虑对抗体同种型、亚型和结合表位进行检测。免疫原性多层级检测决策树参见附录一。
在多层级的分析方法中,筛选试验又称结合抗体试验,用于检测与药物结合的抗体;确证试验用于确定药物结合抗体的特异性;滴度试验用于检测抗药抗体产生的强度;中和抗体是指能够干扰药物与其靶点相互作用的抗药抗体,中和活性试验评估抗药抗体对药物的中和能力/程度。抗药抗体滴度、持续周期、以及中和活性检测信息对于判断抗药抗体对药代动力学、药效动力学、安全性和有效性的影响非常重要。在非临床免疫原性研究中,通常根据非临床药效动力学、药代动力学和安全性的研究结果,以及药物的潜在免疫原性风险确定是否需要进行除抗药抗体发生率以外的研究。
其他分析试验,如抗体同种型、亚型、抗原表位鉴定以及与内源性靶点或其他产品的交叉反应性的评价也具有重要作用。初步的筛选试验应尽可能检测到所有相关的免疫球蛋白(Ig)同种型抗体,但筛选试验无需进一步确定同种型抗体。在某些情况下,应建立可区分同种型抗体的分析方法。例如,对于过敏性反应风险较高或观察到过敏性反应的药物,则需要进行抗原特异性的IgE检测。对于粘膜途径给药,通常涉及到IgA抗体。有时需考虑对抗体亚型进行检测,例如,凝血因子Ⅷ所致的免疫反应可能涉及到IgG4抗体。在有些情况下,可能需要进行与其他蛋白交叉反应的试验,如检测抗药抗体与相应的内源性蛋白的交叉反应性。例如,当治疗性蛋白药物在体内具有一个高同源性的蛋白家族,为了解抗药抗体是否影响蛋白家族中其它蛋白时,通常需要评估抗药抗体的交叉反应性。
对于多结构域治疗性蛋白药物,如聚乙二醇化蛋白、多特异性抗体,建议针对整个治疗性蛋白药物进行初步筛选试验和确证试验,基于风险或产品特征,对确证为阳性的样本进一步开展域特异性评价。
2.分析方法的选择
抗药抗体检测可以采用不同的方法和仪器,包含但不局限于:直接法、桥联法和均相结合法。每种分析方法均有优点和不足,包括检测速度、灵敏度、选择性、方法的响应范围、检测不同免疫球蛋白的能力、检测快速解离出的抗体的能力(如IgM,在免疫反应的早期出现),以及试剂的可获得性。所有的分析方法都应该考虑其检测快速解离出的抗体的能力。如果无法检测到此类免疫反应早期出现的抗体,易造成真正阳性的抗体样本未被检出的情况。在分析中也要重点考虑表位的暴露情况,如果表位与固相载体或者其他报告试剂(如荧光染料、酶或生物素)结合,将导致抗原的构象变化,这将掩盖、暴露、改变或破坏与治疗性蛋白药物相关的抗体的结合位点,从而影响最后的检测结果。
3.试剂的选择
用于抗药抗体检测的有些试剂可以是标准化的或从商业来源获得。然而,特定方法可能需要特定试剂,包括阳性对照抗体、阴性对照和系统适用性对照。应根据检测方法选择合适的试剂,以最小化非特异性信号并维持足够的灵敏度。阳性对照抗体和阴性对照的选择见附录二。
(二)方法学开发与验证
方法学验证的程度主要取决于药物的开发阶段以及潜在的免疫原性风险。对于大多数药物,在药物开发的早期阶段(如非临床、临床Ⅰ期和Ⅱ期研究阶段),应重点考察临界值、灵敏度(包括药物耐受性),选择性和精密度,而弱化稳健性、重现性和稳定性的考察。对于高风险药物,可能需要在临床研究前进行全面验证。对于关键性临床试验和上市后研究,一般需要进行全面的方法学验证。药物开发全生命周期中,有可能根据研究需要进行检测方法参数的调整,在此情况下,应合理追加相关的补充验证内容;对于生物类似药,免疫原性是可比性研究的一部分,在方法学验证中需要增加可比性验证内容。此外,对于某些技术平台,需增加对其他参数的验证,如采用表面等离子共振平台时,需验证表面再生稳定性、芯片基线标准、标记试剂的效能及稳定性等。具体的验证方法参见附录二。
(三)试验内容
1.筛选试验
筛选试验是抗药抗体检测的第一步,该分析方法需具有足够的灵敏度以能检测出样本中低、高亲和力的各种类型抗药抗体。为确保真实样本的检出率,筛选试验应具有一定的假阳性率(通常为5%),但需规避出现假阴性。
方法建立时应尽可能选择与待测样本相同或相近的自然样本群。应根据需求对所选择的方法进行优化。样本(通常是血清或血浆)中可能含有影响检测的成分,可导致产生假阳性或假阴性结果,和/或对抗体含量产生错误评估。例如补体成分或补体受体、甘露糖结合蛋白、Fc受体、可溶性的靶分子及类风湿因子。应采用经确证合理的方法以减少基质效应的潜在影响。
此外,待测样本中的残留药物可能与抗药抗体结合,从而使检测到的抗体含量降低。这种干扰带来的影响取决于分析模式和抗体的特性。可通过多种经验证的方法规避或解决,如酸解离、通过固相吸附除去过量的药物、延长孵育时间、以及稀释样本等方法。在某些情况下,可通过调整给药间隔和采样时间来降低残留药物的干扰。但该方法必须不能对抗体的检测或患者的治疗产生明显影响。通常,应证明分析方法的药物耐受水平超过待测样本中药物的浓度(一般为药物谷浓度)。
2.确证试验
确证试验是为了排除筛选试验中的假阳性样本。筛选试验中检测为阳性的样本,需进一步通过确证试验证明抗药抗体的特异性。
确证试验应与筛选试验具有可比的灵敏度,但需要注意两个试验的假阳性率不同,且确证试验应有更高的特异性,并至少具有与筛选试验相当的选择性,以识别假阳性样本。通常,采用结合竞争抑制法进行检测,即在样本中加入过量的药物,随后同时检测加入药物和未加入药物样本的信号值,若样本中含有抗药抗体,游离的药物将竞争结合抗药抗体,从而造成检出的信号值下降。确证试验的方法和平台可与筛选试验相同,也可不同。方法灵敏度需采用质量单位,并使用系统适用性质控进行确认,当筛选试验和确证试验采用不同方法和平台时,应具有相似的灵敏度。
若选择竞争性抑制方法,则建议使用未给予药物的受试者样本,加入抑制剂(通常是受试药物)后,所产生信号的数据来确定临界值。用于测定临界值的药物的竞争浓度应与将用于样本检测的浓度一致。这种方法可能不适用于在未给药受试者中存在预存抗体的情况,此时建议从临界值的评估中找出疑似阳性结果并予以剔除。当没有本底水平的阴性对照样本时,应采用滴度的改变或正交方法对筛选试验中呈阳性的样本进行确认。对于确证为阳性的样本,在某些情况下,需要对其特异性进行检测,应考虑开发并验证针对样本中杂质诱导产生抗体的检测方法,以区分抗体的结合是针对药物相关成分还是工艺相关成分(如宿主细胞蛋白)。
3.滴度试验
滴度定义为样本检测值高于临界值时的最大稀释倍数。滴度检测常与筛选试验使用相同的平台。一般采用连续稀释方法或通过量效曲线的线性部分外推来确定滴度。
通常,滴度临界值沿用筛选临界值。在某些情况下,也应考虑采用与筛选试验不同的临界值。例如,筛选临界值落在阳性滴度曲线的低平台区时,应建立滴度试验临界值。如无特殊情况,通常采用0.1%的假阳性率确定滴度临界值。当存在预存抗药抗体时,则应根据给药后样本中滴度的提升判断经治疗后样本中抗药抗体的升高。
4.中和活性试验
中和活性是指抗药抗体具有抑制药物生物学活性的能力。中和抗体可以通过阻断产品到达其靶标或干扰受体/配体结合,从而干扰药物的体内活性。
中和活性试验的分析模式选择需要考虑多种因素,包括但不限于药物本身的作用机制、检测方法与体内真实情况的相关性、方法本身的选择性、生物基质的干扰程度、灵敏度和稳健程度等。检测方法与药物体内作用机制的相关性为首要考虑因素。通常采用基于细胞的中和活性检测方法。但是,当药物在体内的作用机制与细胞关系较小,例如体液中游离靶点的拮抗反应、酶反应等,或者由于生物基质干扰等因素,细胞学方法的变异程度、定量范围、灵敏度等难以满足方法学验证和样本分析的需要时,可能需采用基于非细胞的试验方法(配体结合分析、酶反应等)。在某些特殊情况下,结合高度灵敏的药效动力学和/或药代动力学数据可以判断抗药抗体对临床药效的影响,这些试验和指标有可能代替中和抗体试验,这些数据的可替代性应与监管机构进行沟通交流。
基于细胞的中和活性检测方法通常在药物活性测定方法的基础上进行开发,这些方法的形式和测定终点因产品而异。中和活性检测方法开发时,应考察基质效应、药物浓度、配体浓度等,并验证临界值、精密度、选择性、灵敏度等。中和活性分析方法一般不具有很好的药物耐受性,因此应在采样时间点设计上予以考虑。此外,还应该针对不同分析模式的特殊性,考察方法的稳健程度,例如细胞代次等。
通常,基于细胞的中和活性检测方法采用特定浓度的阳性抗体及特定浓度的药物。因此,应对药物的浓度进行筛选,使其产生的细胞效应对中和作用足够灵敏。如果药物的浓度在量效曲线的下半部分,可能没有足够的动态范围响应以显示中和效果。如果在接近量效曲线的平台浓度下进行试验,对于中和抗体含量低的样本,可能检测不出阳性结果。因此,建议选择量效曲线线性范围内的药物浓度进行中和活性试验。
样本基质可干扰中和活性试验,尤其在基于细胞的检测中,基质组分可能增强或抑制药物的活性。例如,患有特定疾病受试者的血清中可能含有高水平的细胞因子,这些因子可能激活细胞,使其对原有刺激因子或药物的应答增强,从而影响中和抗体的检测。因此,应了解这些试验中的基质影响并选择可以被药物特异性激活的细胞系,还可通过特异性抗体抑制或耗竭干扰因子。
中和活性试验需采用未给药受试者的样本,通过试验变异性来确定临界值。如果对筛选和确证试验中检测为阳性的样本进行中和活性检测,通常采用1%的假阳性率。当使用中和活性进行筛选时,应采用5%的假阳性率。如果样本变异程度导致中和抗体活性难以评估,可考虑其他方法,或开发能使变异性降低并获得更准确临界值的方法。
中和活性试验通常采用固定临界值,基于药物作用机制可采用信号抑制或刺激百分比来表示;亦可采用浮动临界值。
中和活性试验一般仅对抗药抗体阳性样本进行检测,通常不需要确证研究。由于生物活性检测具有一定的复杂性,某些情况下,需要进一步确定受试者是否产生了真正的中和抗体,应考虑以下方面:(1)不相关的抑制分子可能引起中和活性,从而难以确认中和活性是由中和抗体还是其他抑制分子导致。若担心存在非特异性抑制,应考虑进行竞争试验。(2)除了药物,细胞系可能对多种刺激产生应答。在这种情况下,可在药物存在时检测中和抗体,此时中和抗体应答会被特异性阻断,而其它刺激引起的应答不会被阻断。(3)基质含有的可溶性受体或内源性药物类似物可能导致错误结果。在这种情况下,直接进行基质样本的检测或封闭基质因子(若已知)有助于了解试验结果。(4)还应考虑样本中是否存在药物,特别是半衰期较长的药物。
自德国诺贝尔奖获得者保罗·埃利希(Paul Ehrlich)最早于1913年提出ADC药物的概念至今,ADC药物经历了三代创新。ADC药物进入血液循环并与肿瘤细胞表面的靶抗原受体结合后,新形成的ADC抗原复合物在内化后会被溶酶体降解,释放有效载荷并诱导肿瘤细胞死亡(图1)。有效载荷是ADC设计的重要组成部分,其作用机制是决定ADC性能的重要因素。
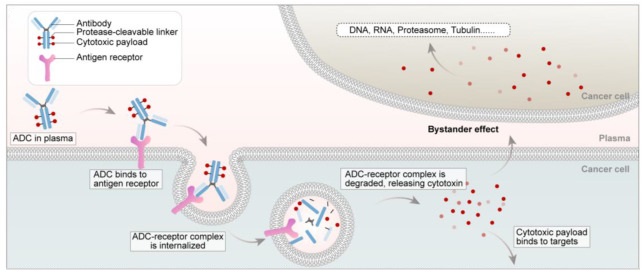
图1 ADC药物作用机制
第一代ADC药物多选用甲氨蝶呤、长春碱和多柔比星等传统化疗药物作为细胞毒性有效载荷。然而,由于它们对癌细胞的细胞毒性不足,在靶细胞中的低积累,疗效不及亲本有效载荷,导致研发在临床阶段失败。随后,第二代ADC药物的有效载荷聚焦在新型高细胞毒性化合物,其活性比第一代ADC中使用的传统化疗药物强100至1000倍。当它们单独使用时,往往伴随难以接受的严重副作用,因此多未能作为用于癌症治疗单一药物被批准。有趣的是,这些高细胞毒性化合物是ADC药物理想的有效载荷。大多数第二代ADC有效载荷为微管蛋白抑制剂,虽然对活跃分裂的肿瘤细胞非常有效,但对静态癌细胞的效果要差得多。为了克服这一局限性,第三代ADC药物多选择可以靶向整个细胞周期的DNA损伤剂作为有效载荷。DNA损伤剂可以通过双链断裂、烷基化、嵌入和交联来破坏DNA结构以杀死肿瘤细胞。
有效载荷的活性和理化性质直接影响ADC药物的抗肿瘤疗效,其细胞毒性、免疫原性、制备和循环过程中储存的稳定性、水溶性和可改造性也很重要。理想的有效载荷应具有以下特征:
(1)高细胞毒性。肿瘤特异性抗原非常有限,尤其是在实体瘤中。此外,由于单克隆抗体的通透性低,内化活性差,通过抗体抗原结合可以内吞到肿瘤细胞中的ADC有效载荷数量非常少。
(2)低免疫原性。尽管目前ADC药物的抗体部分使用人源或人源化单抗,但仍有诱导免疫反应的风险,这可能会对ADC的疗效产生负面影响。一些从植物、动物或微生物中提取的剧毒有效载荷,可以确保在人体中的免疫原性足够小,甚至可以忽略不计。使用较小分子量的有效载荷也是降低免疫原性风险的一种方法。
(3)高稳定性。由于抗体在循环中的半衰期很长,因此ADC药物应在血液循环中保持稳定,以避免释放或分解。有效载荷还应在细胞质和溶酶体中保持稳定,在低pH条件下不会发生明显降解。
(4)具有可以改造的官能团。有效载荷必须具有可修饰的官能团或可与单克隆抗体偶联的位点。必须仔细选择修饰的部位,以保持亲本药物的效力。更重要的是,当使用不可切割的接头时,即使在抗体降解后,有效载荷也必须保持效力。
(5)具有旁观者杀伤效果。一些ADC药物被内化后可释放出不带电荷的、易透过细胞膜的小分子,这些小分子通过细胞膜扩散并杀死相邻抗原阴性表达的肿瘤细胞。这一过程被称为“旁观者杀伤效应”,对抗原表达不均匀的肿瘤细胞具有重要意义。一般来说,促进癌细胞中旁观者杀伤效应的有效载荷更适合靶抗原低表达或异质表达的癌症。要构建具有旁观者效应的ADC药物,其结构必须满足连接子可以被裂解,有效载荷可渗透细胞膜的条件。具有强旁观者杀伤作用的有效载荷,也可能容易被健康组织吸收,导致严重的全身毒性,如何平衡两者效果非常重要。
(6)具有适当的水溶性。有效载荷必须具有适当的水溶性,以促进与抗体的偶联,并确保偶联物在生理条件下具有足够的溶解度。当过多的疏水有效载荷与抗体偶联时,产生的ADC往往会聚集并变得不稳定。此外,有效载荷的亲水性会影响亲本ADC或其代谢物的细胞膜通透性,从而影响其旁观者杀伤活性。
(7)细胞内毒性靶标。部分有效载荷为膜靶向性的,例如通过阻断离子通道或破坏凝血起作用的有效载荷,不适合用作ADC的有效载荷。目前,ADC的细胞内靶点集中在核酸或微管蛋白上。
微管是真核细胞细胞骨架的重要组成部分,在维持细胞形态、信号转导、胞内物质转运、细胞运动、细胞分裂、有丝分裂等各种细胞功能中发挥着重要作用,是肿瘤治疗的重要靶点。微管由微管蛋白组成,微管蛋白抑制剂通过与微管蛋白结合来干扰微管的动态结合,使细胞停滞在细胞分裂的G2/M期,并最终导致细胞凋亡。与大多数缓慢生长的正常细胞相比,微管抑制剂对处于快速分裂的癌细胞的毒性更强,是目前ADC药物最常用的有效载荷类型。
微管蛋白抑制剂可分为微管蛋白聚合抑制剂和微管蛋白聚合稳定剂,代表药物分别是长春碱类和紫杉烷类,已上市的ADC有效载荷多属于前者。
海兔毒素10(Dolastatin 10)是从海洋软体动物Dolabella auricularia中提取的一种线性五肽,由dolavaline(Dov)、valine(Val)、dolaisoleuine(Dil)、dolaproine(Dap)和dolaphenine(Doe)5个片段缩合而成。其作用机制通过N端与微管蛋白的长春花碱结合域,阻止其结合蛋白,抑制其介导的聚合作用;C端停留在微管蛋白可交换的三磷酸鸟苷结合位点周围,阻止其水解,从而抑制细胞的有丝分裂。小鼠模型中,海兔毒素10对L1210白血病细胞(IC50 0.01~1.00 nmol/L)、淋巴瘤细胞(IC50 0.1~1.0 pmol/L)、卵巢癌细胞(IC50 0.05~1.80 nmol/L)、结肠癌细胞(IC50 0.02~0.20 nmol/L)和肺癌细胞(IC50 0.03~0.18 nmol/L)都具有良好的抗肿瘤活性,但是对造血祖细胞也有毒性,临床上已停止单独使用该药。

图2 海兔毒素10化学结构图
其结构类似物单甲基奥瑞他汀E(MMAE)和单甲基奥瑞他汀F(MMAF)是ADC药物在研临床试验中采用最多的有效载荷。MMAE与海兔毒素10相比,C端去除了Doe的噻唑环,多了甲基和羟基,N端的叔胺变为仲胺,增加了偶联位点。MMAE结构对单抗的理化性质基本没有影响,而且保持高度稳定,在人肝脏和血浆中没有降解的迹象。MMAE作为游离的毒素,在淋巴瘤细胞中的毒性只有海兔毒素10的1/200。当其与抗体连接后,对淋巴瘤细胞的毒性能达到海免毒素10的水平。游离的MMAE表面呈电中性且通过可裂解型连接子释放,可以更容易地穿过细胞膜发挥旁观者效应。

图3 MMAE化学结构图
MMAF末端的苯丙氨酸取代带破坏了细胞膜穿透性,降低了细胞毒性和脱靶毒素的代谢速率,从而限制了显著减少了毒副作用。MMAF在淋巴瘤细胞中的毒性只有海兔毒素10的千分之一,但通过抗体进入肿瘤细胞后,活性比单独MMAF高2200倍。MMAF具有良好的亲水性,可以在一定程度上降低ADC发生聚合和沉淀的风险,而且不需要对N端进行显著修饰就可以保持原有的活性,所以临床上一般采用不可断裂的硫醚键-马来酰亚胺基已酰基(MC)将抗体与MMAF相连,提高了药物的安全性。

图4 MMAF化学结构图
Adcetris®是美国FDA批准的第一款使用奥瑞他汀类有效载荷的ADC药物,是由Seagen公司研发用于治疗CD30阳性的霍奇金淋巴瘤(HL)和系统性间变性大细胞淋巴瘤(sALCL)。该药由靶向CD30的嵌合IgG1单克隆抗体cAC10和MMAE通过蛋白酶敏感的可裂解连接子瓜氨酸-缬氨酸二肽(Val-Cit)随机偶联而成,平均药物/抗体比率(DAR)为4。

图5 Adcetris®结构示意图
美登素(Maytansine)最初是从非洲灌木Maytenus ovatus的树皮中分离出来的天然产物,是一类与微管蛋白结合并抑制微管组装的苯并大环内酯类生物碱。在体外细胞活性测定中,其IC50属于皮摩尔范围,显示出其抑制肿瘤细胞增殖的强大能力。同时还显示出良好的稳定性和溶解度。然而,由于其治疗窗口狭窄,以及由于缺乏选择性而产生的神经毒性和胃肠道反应等毒副作用,临床上已禁止直接用于治疗。然而,美登素的高细胞毒性完全满足了ADC有效载荷的要求,使美登素成为ADC有效载荷的有力候选者。
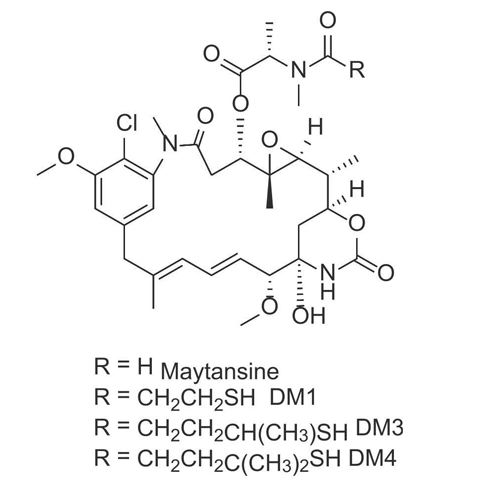
图6 美登素及其衍生物化学结构图
由于美登素没有反应性官能团,缺乏偶联位点,需要对原有结构进行修饰。对美登素类化合物构效关系(SAR)的研究已确定C3 N-酰基-N-甲基-L-丙氨酰酯侧链、C4-C5环氧化物部分、C9甲醇官能团以及C11和C13共轭双键的位置是活性的关键基团。这使得苯环和N-酰基成为化学上可修饰的实体。用3-甲基二硫代丙酰基取代美登素中的N-乙酰基,可以得到美登素衍生物DM1。DM4是通过在DM1二硫键周围添加两个甲基而获得的。DM1和DM4具有甲硫丙酰基,可以通过二硫键与连接子偶联。DM1和DM4是临床实际应用中最常用的两种美登素类有效载荷,如基于美登素衍生物获批上市的ADC药物T-SMCC-DM1。
Halichondrin B是最初从海绵Halichondraria Okadai中分离出来的聚醚大环内酯类的天然产物,被证明具有良好的抗增殖活性。其结构简化的全合成类似物甲磺酸艾日布林是一种具有抗有丝分裂作用的微管动力学抑制剂,已于2010年FDA获批用于治疗局部晚期和转移性乳腺癌(MBC)患者。

图7 甲磺酸艾日布林化学结构图
艾日布林具有独特的作用机制:它能够抑制微管聚合,不影响微管解聚,从而阻止纺锤体形成,最终导致有丝分裂停滞和随后的细胞凋亡。由于这种作用机制,艾日布林可能在紫杉烷类耐药肿瘤细胞系的情况下显示出活性。此外,艾日布林可以影响肿瘤微环境,恢复脉管系统,增加药物灌注,下调血管内皮生长因子(VEGF)和TGFβ基因的表达。这些改变可能通过减少缺氧驱动的耐药性,增加药物的肿瘤内递送,潜在地增强随后给药的治疗。
MORAb-202是由卫材研发的靶向FRα的ADC药物,由可裂解连接子Val-Cit将甲磺酸艾日布林通过半胱氨酸偶联偶联至人源化单克隆抗体farletuzumab上,DAR为4,具备旁观者效应,目前针对铂耐药卵巢癌正在Ⅱ期临床研究中。FRα(FOLR1)是一种通过GPI锚定于细胞膜的单链糖蛋白,它在正常组织中基本不表达,但在上皮来源的恶性肿瘤中过度表达,包括卵巢癌、肺癌和乳腺癌,已成为ADC药物研发的潜力靶点。
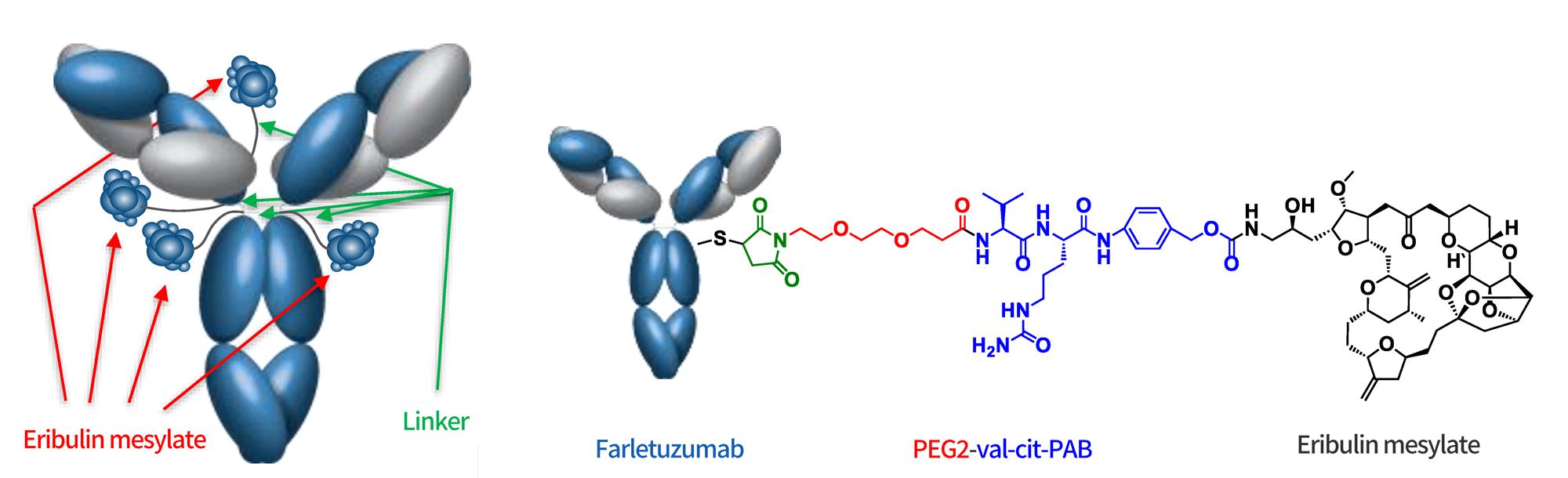
图8 MORAb-202结构示意图
Tubulysin家族是Hofle等人从黏菌培养基中分离出的天然抗有丝分裂肽,是一种线性四肽,由N-甲基-D-哌啶甲酸(D-Mep)、L-异亮氨酸(L-Ile)、Tubuvaline(L-Tuv)和Tubuphenylalanine(Tup)或Tubutyrosine(Tut)4种非天然氨基酸组成。Tubulysins可抑制微管蛋白的聚合,诱导细胞凋亡,对包括多重耐药KB-V1细胞在内的癌细胞具有较强的抗增殖活性(IC50=0.08 nmol/L),在抗癌药物开发方面具有良好的前景。

图9 Tubulysins化学结构图
对于Tubulysins的构效关系:1)Mep环是活性的关键,去掉Mep环将导致活性丧失;2)N,O-缩醛对活性影响不大,引入疏水基团可提高生物活性;改造O-乙酰基对活性影响大,优选R构型,其构型将影响微管蛋白组装;3)Tup片段的羧基甲酯化后能够提高活性,另外富电子的芳环也是活性必须的。
DXC005是由多禧生物研发的MUC1靶向ADC药物,由Tub201分子和抗MUC1单克隆抗体(IgG1)偶联而成的,Tub201分子为Tubulysin B 类似物。使用含有亲水且缓慢释放的连接子,通过连接子末端马来酰亚胺基团偶联到抗MUC1单抗体的半胱氨酸硫醇基团上。平均DAR约为4.0~4.2。拟适用的适应症为实体瘤,包括胰腺癌、结直肠癌、食管癌、卵巢癌等,目前针对胰腺癌、结直肠癌处于临床Ⅰ期。
参考文献
[1]Wang ZJ, Li HX, Gou LT, et al. Antibody-drug conjugates: Recent advances in payloads[J]. Acta Pharm Sin B, 2023, 13(10): 4025-4059. doi: 10.1016/j.apsb.2023.06.015.
[2]范啸宇,高文龙,杜子秀.auristatin类细胞毒素及其在抗体药物偶联物中的应用[J].国际生物制品学杂志, 2018, 41(5):5. DOI:10.3760/cma.j.issn.1673-4211.2018.05.010.
[3]Akaiwa M, Dugal-Tessier J, Mendelsohn BA. Antibody-Drug Conjugate Payloads; Study of Auristatin Derivatives[J]. Chem Pharm Bull (Tokyo). 2020, 68(3): 201-211. doi: 10.1248/cpb.c19-00853.
[4]周磊,张国宁,王菊仙,等.美登素类抗体药物偶联物研究进展[J].中国新药杂志, 2016, 25(22):410-419.
[5]De Sanctis R, Jacobs F, Benvenuti C, et al. From seaside to bedside: Current evidence and future perspectives in the treatment of breast cancer using marine compounds. Front Pharmacolp[J]. 2022, 8(13): 909566. doi: 10.3389/fphar.2022.909566.
[6] Furuuchi K, Rybinski K, Fulmer J, et al. Antibody-drug conjugate MORAb-202 exhibits long-lasting antitumor efficacy in TNBC PDx models. Cancer Sci. 2021 Jun;112(6):2467-2480. doi: 10.1111/cas.14898.
[7]Leverett CA, Sukuru SC, Vetelino BC, et al. Design, Synthesis, and Cytotoxic Evaluation of Novel Tubulysin Analogues as ADC Payloads. ACS Med Chem Lett. 2016, 7(11):999-1004. doi: 10.1021/acsmedchemlett.6b00274.
[8]熊樱,李英霞.海洋来源的微管蛋白聚集抑制剂tubulysins的研究进展[J].中国海洋药物, 2020, 39(2):87-92.
禽类抗体在生命科学与医学领域中的应用越来越受到关注。由于禽类与哺乳动物系统的遗传距离、抗体多样化的机制以及IgY在蛋黄中沉积的方式,使得禽类特别是鸡作为免疫宿主具有许多优势。首先,禽类与哺乳动物间的遗传距离较远,对哺乳动物源的抗原物质容易产生强免疫应答,且可以针对更多哺乳动物抗原表位形成抗体。其次,IgY具有较强的耐热、耐酸、耐高渗性能以及一定的抗酶解能力,这可能是IgY重链上额外的二硫键提供了更高的分子稳定性。CDR3区是决定结合抗体亲和力和特异性的主导区域。与IgG相比,IgY重链CDR3残基数更多,这使得IgY的亲和力和特异性更好。最重要的是,IgY的Fc区不与哺乳动物的Fc受体、类风湿因子(RF)、CF(尤其是C1q和C3)以及蛋白A、蛋白G、蛋白L发生相互作用,可以避免免疫分析中的显著干扰和交叉反应。基于以上优势,禽类IgY抗体开始广泛运用于免疫诊断或治疗性抗体药物的开发。
在免疫检测中,样本中存在的内源性干扰物质,如异嗜性抗体(HA)、人抗动物抗体(HAAA)和类风湿因子(RF)会通过与抗体的非特异性结合,降低检测的灵敏度和特异性,导致假阳性或假阴性结果。此外,通过抗体Fc受体或凝集素的非抗原依赖性特异性结合或其他基于非免疫球蛋白的相互作用,如由补体因子介导的相互作用,也可能导致检测结果的偏颇。据统计,异嗜性抗体对检测结果的干扰变化范围从1%至80%。对超过11000份检测CEA的血清进行更彻底的分析后发现,约4%的检测结果可能是错误的。消除异嗜性抗体干扰的方法包括去除阻断干扰性抗体,然而使用这类方法想要完全解决这些问题的可能性不大。
IgY的最有趣且不寻常的特征就是Fc区不与哺乳动物的Fc受体、类风湿因子(RF)、CF(尤其是C1q和C3)以及蛋白A、蛋白G、蛋白L发生相互作用。这使得IgY特别适合应用于容易产生不必要交叉反应的检测。如在一项蛋白质组学研究中,使用特异性IgY预处理血清样品,中和高丰度血清成分,可以改善下游分析。在另一项研究中,使用特异性IgY作为封闭试剂,简化了低丰度血清蛋白的检测和疾病标志物候选物的发现。
表1 IgY在免疫诊断中的优势
| 哺乳动物IgG | 禽类IgY | |
|---|---|---|
| 主要来源 | 血浆 | 蛋黄 |
| 哺乳动物抗原抗体滴度 | 通常较低 | 通常较高 |
| 与Protein A/Protein G 结合 | ++++ | – |
| 与哺乳动物细胞Fc受体结合 | ++++ | – |
| 免疫复合物激活哺乳动物补体系统 | ++++ | – |
| 抗体生产能力 | 90天免疫/50~70mL血清 500~700 mg IgG | 90天免疫/60个鸡蛋 3-6 g IgY |
| 应用 | RIA、IRMA、ELISA、Western blot、FACS等 | RIA、IRMA、ELISA、Western blot、FACS等 |
禽类和哺乳动物之间的系统发育距离确保了禽类对哺乳动物源抗原的强免疫反应。这种特征有利于产生针对哺乳动物肿瘤抗原的IgY。Amirijavidv等人针对TRAIL受体TRAIL-R2(DR5)胞外段上的21个氨基酸制备了高度特异性的IgY。这种IgY与受体胞外肽段结合后,激活人乳腺癌细胞MCF7中的DR5受体,作为TRAIL激动剂诱导细胞凋亡。YAN等通过构建靶向HER2的IgY与单壁碳纳米管(SWNT)的偶联复合物,在表达HER2的SK-BR-3细胞和HER2阴性的MCF-7细胞的体外模型中证明了该复合物检测和选择性破坏癌细胞的双重功能。这些研究表明,针对肿瘤抗原产生的IgY是更具选择性的癌症治疗替代方案。
抗生素在养殖业中一直用于促进生长(亚治疗剂量)、疾病预防(预防剂量)和治疗感染。饲料中抗生素的过量使用和误用导致了动物产品中药物残留的问题和耐药性的增加。IgY作为一种预防和控制禽畜疾病的手段引起了相当的关注。与哺乳动物IgG治疗相比,IgY摆脱了使用抗体口服免疫疗法极高的成本约束——母鸡可以看作是生产抗体的小型“工厂”:一只母鸡通常每年产下约300个鸡蛋,每个蛋黄含有50-100mg的IgY,其中2%至10%是特异性抗体。因此,免疫一只母鸡每年可产生超过22500 mg的IgY,相当于4.3只兔子一年产生抗体的量。饲养母鸡的维护成本也低于兔子等哺乳动物。
IgY抵御病原体活性的机制概述如下:
使用IgY处理后,可以观察到细菌生长或定植被抑制,这种作用并非是对单个细菌的直接影响,而是由于IgY的两个Fab臂的空间位阻,阻碍了细菌的交联,从而导致细菌凝集。
一些体外研究表明,抑制黏附是特异性IgY抵消病原体活性的主要机制。暴露在革兰氏阴性菌表面的特定成分,如外膜蛋白、脂多糖、菌毛和鞭毛,它们是细菌定植的关键因素,可以被相应的特异性抗体识别和结合。这种结合可能会阻断或损害细菌生长相关功能的成分,抑制细菌生长。
有研究发现IgY改善了中性粒细胞对金黄色葡萄球菌的吞噬作用。与此类似,IgY存在的情况下,乳巨噬细胞或多形核中性粒细胞对大肠杆菌的吞噬活性显着增加。这些结果表明,IgY增强了吞噬活性。通过与特异性IgY结合,观察到细菌表面结构改变,这些变化可以通过细菌表面电子云和/或电场的变化来解释,导致细菌细胞更容易受到吞噬作用的影响。
金黄色葡萄球菌荚膜是引起牛乳腺炎发作的重要致病菌之一。IgY可以阻止乳腺上皮细胞对金黄色葡萄球菌的内化,这表明IgY控制牛乳腺炎的主要途径为中和毒素活性,而不是直接抑制生长。
表2 IgY在禽畜疫病防治中的应用
| 病原体名称 | IgY的作用 | 文献来源 |
|---|---|---|
| 轮状病毒 | 预防牛轮状病毒引起的犊牛腹泻 | Kuroki et al. (1994) |
| 预防鼠轮状病毒 | Yolken et al. (1988) | |
| 预防人类轮状病毒引起的小鼠胃肠炎 | Ebina (1996) | |
| 预防和治疗轮状病毒诱导的小鼠胃肠炎 | Hatta et al. (1993) | |
| 轮状病毒感染体外预防:使用IgY对抗重组HRV外壳蛋白VP8* | Kovacs-Nolan et al. (2001) | |
| 冠状病毒 | 保护新生犊牛免受牛冠状病毒(BCV)引起的腹泻 | Ikemori et al. (1997) |
| 大肠杆菌 | 预防新生仔猪K88+、K99+、987P+ETEC感染 | Yokoyama et al. (1992) |
| 保护新生犊牛免受致命的肠道大肠杆菌病(ETEC K99)的侵害 | Ikemori et al. (1992) | |
| 抑制ETEC K88对仔猪肠黏液的黏附 | Jin et al. (1998) | |
| 预防新生儿和早断奶仔猪ETEC K88+感染 | Marquardt et al. (1999) | |
| 沙门氏菌 | 保护小鼠免受肠炎沙门氏菌或鼠伤寒沙门氏菌的侵害 | Yokoyama et al. (1998) |
| 预防暴露于鼠伤寒沙门氏菌或都柏林沙门氏菌的新生犊牛发生致命感染 | Yokoyama et al. (1998) | |
| 抑制肠炎沙门氏菌与人肠道细胞的黏附 | Sugita-Konishi et al. (1996) | |
| 耶尔森氏菌 | 保护虹鳟鱼免受鲁氏耶尔森氏菌感染 | Lee et al. (2000) |
| 爱德华兹氏菌 | 预防迟缓爱德华氏菌对日本鳗鱼的感染 | Stevenson et al. (1993) |
| IBDV | 保护雏鸡免受传染性法氏囊病毒的侵害 | Gutierrez et al. (1993) |
| 葡萄球菌 | 抑制金黄色葡萄球菌A型肠毒素的产生 | Sugita-Konishi et al. (1996) |
| 假单胞菌属 | 抑制绿脓杆菌的生长 | Sugita-Konishi et al. (1996) |
参考文献
[1]Dias da Silva W, Tambourgi DV. IgY: a promising antibody for use in immunodiagnostic and in immunotherapy. Vet Immunol Immunopathol, 2010, 135(3-4):173-80.
[2]Spillner E, Braren I, Greunke K, et al. Avian IgY antibodies and their recombinant equivalents in research, diagnostics and therapy. Biologicals, 2012, 40(5):313-22.
[3]Pereira EPV, van Tilburg MF, Florean EOPT, et al. Egg yolk antibodies (IgY) and their applications in human and veterinary health: A review. Int Immunopharmacol, 2019, 73:293-303.
[4]Xu Y, Li X, Jin L, et al. Application of chicken egg yolk immunoglobulins in the control of terrestrial and aquatic animal diseases: a review. Biotechnol Adv, 2011,29(6):860-8.
免疫球蛋白Y(IgY)是一种广泛存在于鸟类、爬行动物、两栖动物和肺鱼中抗体同种型,它在结构和功能上与哺乳动物的IgG和IgE同源,被认为是IgG和IgE的进化前体。禽类IgY在功能上与哺乳动物IgG相似,曾被提议应命名为“禽类IgG”。(本文禽类IgY抗体均特指鸡IgY)。
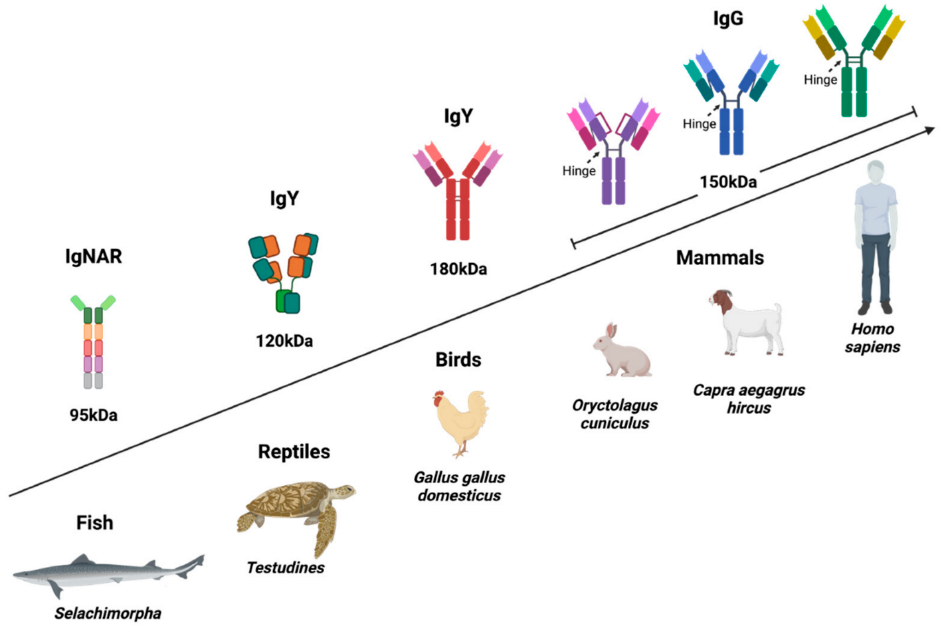
图1 IgY与不同物种的IgG的结构比较
免疫球蛋白呈对称的Y型结构,通常由两条相同的重链和两条相同的轻链组成。哺乳动物IgG重链恒定区由CH1、CH2和CH3组成,其中CH2和CH3构成Fc区。轻链只有一个恒定区,用CL表示。可变区片段Fv由重链可变区(VH)和轻链可变区(VL)组成。VH和VL分别与CH1和CL相连,共同组成Fab区。重链和轻链之间通过CH1和CL所含半胱氨酸形成的二硫键相连,Fab和Fc通过位于重链的CH1和CH2之间的铰链区相连,两条重链通过铰链区内的二硫键相连,最终形成一个约150 kDa的抗体分子。
哺乳动物IgG和禽类IgY在结构上的差异主要体现在恒定区。IgY的CH1和CH2之间缺乏铰链区,这限制了IgY的柔韧性,铰链区中连接两条重链的二硫键也相应缺失。IgY连接两条重链的二硫键位于CH2,该区域存在四个典型的半胱氨酸,其中两个形成重链链间二硫键,其余两个形成链内二硫键。除此之外,IgY存在额外的CH4域。因此IgY的分子量(180 kDa)略高于IgG。
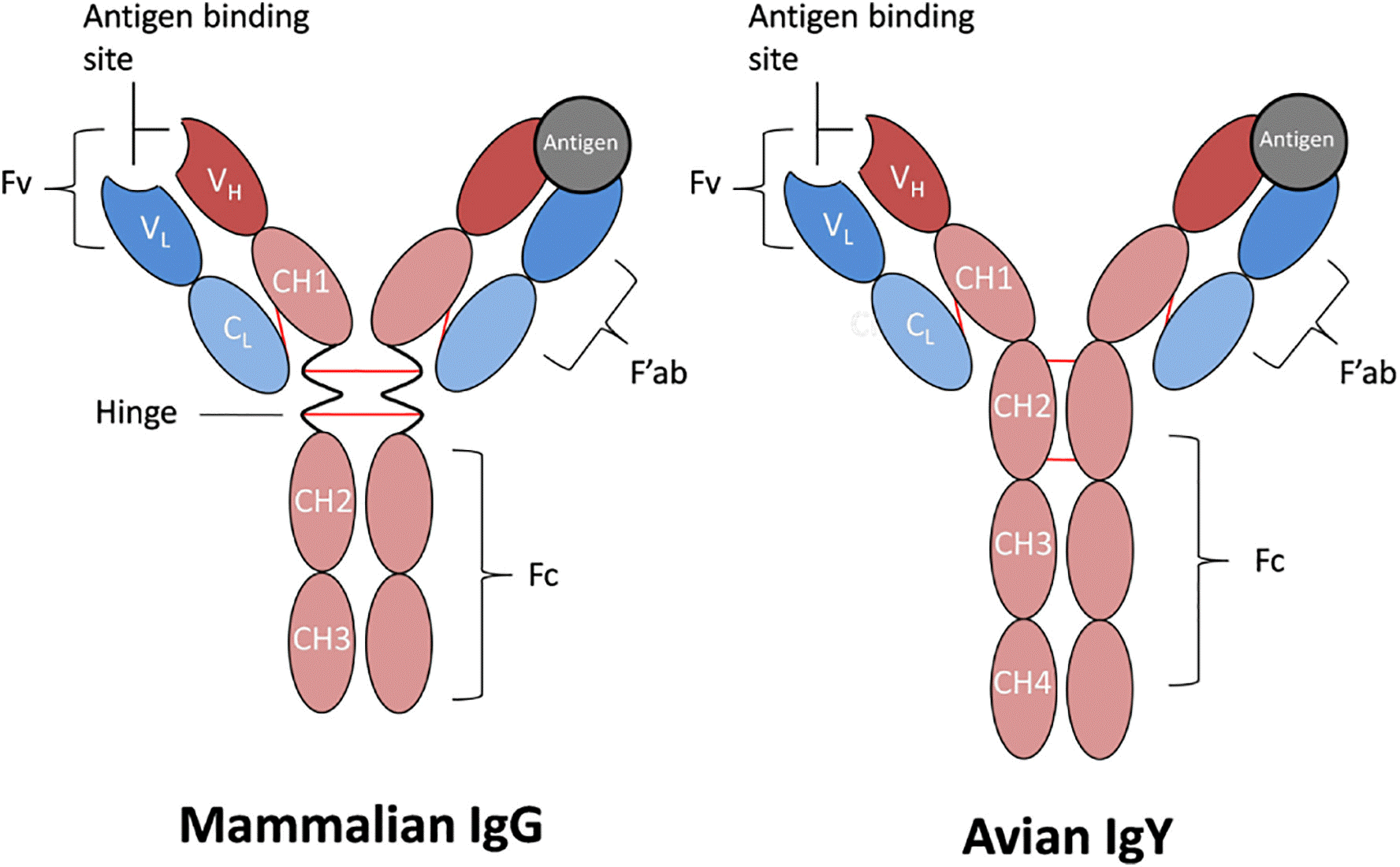
图2 IgG和IgY的典型结构
通过对未免疫处理鸡抗体库VH序列的分析发现,与IgG相比,IgY VH CDR3残基数较多;此外,IgY VH CDR3含有非规范内的半胱氨酸残基,这些残基可形成链内二硫键,赋予结构额外的稳定性,这一特征在IgG VH CDR3中不明显。

图3 鸡、小鼠、人的CDR3长度分布比较
红色:未免疫鸡VH CDR3长度分布
灰色:小鼠VH CDR3长度分布
黑色:人类VH CDR3长度分布
至于VL链,禽类只表达λ轻链,而哺乳动物主要表达κ轻链。IgY VLλ与哺乳动物IgG VLλ在序列和结构上具有显著的同源性。一个显著的区别是,IgY VLλ CDR1的标准结构要比IgG的明显要短。这种差异在分析种系和免疫处理后鸡的VLλ CDR时也被观察到了,因此推测这与抗原驱动因素无关。这可能出于进化压力,这样IgY较短的VL CDR1可以与较长的VH CDR3之间做到结构互补。
禽类免疫球蛋白种系基因包括VL基因位点上的V基因片段和J基因片段,以及VH基因位点上额外的D基因片段。与人类、小鼠VH基因家族和VL基因家族中存在多个种系不同,禽类VH和VL基因家族只存在一个功能性的基因片段。因此禽类抗体中虽然存在V-D-J和V-J重排,但重排过程对抗体序列多样性的贡献很小。禽类抗体的多样性主要是通过V-D-J和V-J重排后的基因转换和体细胞超突变机制产生的。
基因转换是指供体基因片段单向转移到同源受体基因片段,导致供体序列在该区域复制的过程。受体片段可发生多次转换事件,这是禽类IgV基因库多样性产生的重要机制。位于5’端上游的80~100个重链假基因(ψVH)和25个轻链假基因(ψVL)与重排的VH和VL基因片段具有同源性,可以为V区受体提供供体序列。大多数基因转换事件发生在VH的D基因片段,这是CDR3多样性的保证。而VL基因转换仅发生于VL区而不延续到JL区。基因转换过程会在个体VH和VL库中产生大量的排列,再加上重轻链的配对,可以产生约3×109种组合的抗体库。
产生多样性的另一种机制称为体细胞超突变。体细胞突变在分裂细胞中发生的频率较低,但它在B细胞中发生频率较高(单个细胞分裂过程中,每103个核苷酸对中就有一个突变发生)。这种比其他细胞高一百万倍的点突变率仅出现于重排的Ig基因位点。点突变除了大幅增加抗体库多样性外,还使得对特定抗原具有高亲和力的免疫球蛋白出现。
与其他抗体同种型类似,IgY除了可变区具有抗原中和能力外,Fc区也具有相当一部分的免疫调节功能。IgY的Fc区是Gallus Gallus Fc受体(ggFcR)和鸡免疫球蛋白样受体簇(CHIR)及其同源物的配体。在属于CHIR簇的受体中,研究最多的是CHIR-AB1。IgY-ggFcR相互作用类似于受体配体比例为1∶1的IgG-Fc-FcγR相互作用,而IgY-CHIR-AB1相互作用类似于受体配体比例为2∶1的IgA-FcαR1受体相互作用。
由于残基基团和/或结构构象的差异,IgY的Fc区不能与哺乳动物的Fc受体、类风湿因子(RF)、CF(尤其是C1q和C3)以及蛋白A、蛋白G、蛋白L发生相互作用。由于IgY不能与上述哺乳动物免疫调节蛋白结合,可以避免免疫测定中哺乳动物免疫复合物的天然相互作用所带来的显著干扰和交叉反应。使用IgY还可以避免哺乳动物Ig的疗法可能产生的不良继发免疫反应。此外,加深对IgY与鸡免疫调节蛋白的相互作用的理解可以进一步优化多克隆/单克隆IgY检测或纯化方法。如可以通过CHIR1-AB1-哺乳动物Fc融合蛋白来简化IgY检测方法:使用预制或商业化的抗哺乳动物Fc二抗检测抗原结合的IgY,这样无需制备或购买新的抗IgY二抗。
表1 IgY、IgG和IgE与特定受体/配体的不同相互作用区域
| 受体和/或配体 | 相互作用区域/特征 | ||
|---|---|---|---|
| IgY | IgG | IgE | |
| CHIR-AB1 | CH3-CH4域间 | – | – |
| ggFcR | CH2-CH3域间 | – | – |
| FcRY | CH3-CH4域间 | – | – |
| IgG-FcγR | – | CH2-CH3域间,CH2铰链区 | – |
| IgE-FcεR | – | – | CH3-CH4域间 |
| 类风湿因子(RF) | – | CH2-CH3域间 | 可能为CH3-CH4域间 |
| 补体因子(CF) | – | CH2-CH3域间,CH2铰链区 | – |
| 蛋白A | – | CH2-CH3域间,可能涉及CH2铰链区 | CH2 N端 |
| 蛋白G | – | CH2-CH3域间 | – |
| 蛋白L | – | Kappa轻链 | Kappa轻链 |
IgY具有高稳定性,在室温下可保持活性6个月,在4°C下可保持活性5年,在70°C下可以保持相对稳定15分钟;并且在pH值为4~11时具有高活性。有研究从结合活性和构象变化两方面比较兔IgG和鸡IgY的分子稳定性。结果发现,与兔IgG相比,鸡IgY在碱性和酸性pH下表现出更高的稳定性,同时在高温条件下(45℃,60℃)保持稳定的时间更长。IgY重链上的额外结构域在提供更高的分子稳定性方面发挥了重要作用。
参考文献
[1]Wu L, Oficjalska K, Lambert M, et al. Fundamental Characteristics of the Immunoglobulin VH Repertoire of Chickens in Comparison with Those of Humans, Mice, and Camelids. The Journal of Immunology, 2012, 188(1): 322-333.
[2]Lee W, Syed Atif A, Tan SC, et al. Insights into the chicken IgY with emphasis on the generation and applications of chicken recombinant monoclonal antibodies. J Immunol Methods, 2017, 447: 71-85.
[3]Yakhkeshi S, Wu R, Chelliappan B, et al. Trends in industrialization and commercialization of IgY technology. Front Immunol. 2022, 13:991931.
[4]Gandhi S, Alshehri SM. Molecular stability of the rabbit and chicken egg yolk immunoglobulins. Front Biosci (Elite Ed), 2021,13(1):185-194.

南京德泰生物工程有限公司 Nanjing Detai Bioengineering Co.,Ltd. ©2025 All Rights Reserved