
抗体作为一种常见的生物学研究工具,高特异性、高效价的抗体是进行科研实验研究的基础,抗体纯度的高低将直接影响实验的成败。通过不同方法制备的抗体往往与多种杂蛋白混杂在一起,为了获得成分相对单一的抗体,需要进行抗体纯化。
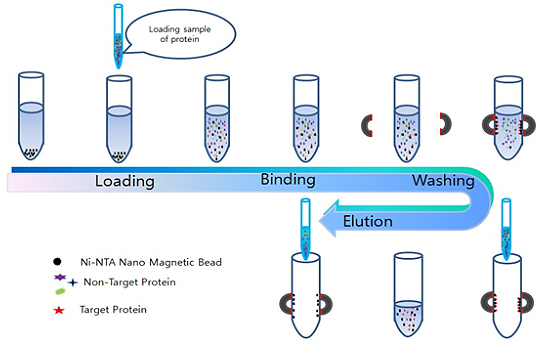
图1:抗体纯化流程图
制备抗体的血清或腹水直接用盐析法进行处理,可以将这些物质里面的其他杂质去掉获得蛋白的成分,这个过程称为抗体的粗纯化。粗提纯比较常用的方法是硫酸铵盐析法和硫酸钠盐析法。将饱和硫酸铵加入血清或者腹水中来沉淀抗体,通过离心分离沉淀与未沉淀的蛋白质,用水溶剂将沉淀重悬后,所得的溶液即为富含抗体的液体。粗纯化后得到的液体仍有大量的杂蛋白,需进一步进行纯化。

相关阅读:抗体四大纯化方法介绍
利用蛋白质A/G纯化抗体是目前最常用的抗体纯化方法,通常纯化后的终产品纯度可达95%,可用于各种实验操作。其纯化原理为:protein A、Protein G可以与抗体的Fc段结合,混合物流过含有蛋白A/蛋白质G的纯化柱,混合物中的抗体会与protein A/Protein G结合,从而被纯化出来。
与蛋白质A/G纯化抗体原理相似,蛋白L也是利用亲和纯化的原理,利用待分离物质和它的特异性配体间的特异亲和力,达到分离纯化的目的。蛋白质L可以和抗体的轻链结合,通常用来纯化IgM、Fab 及 F(ab’)等抗体或抗体片段。
特异性纯化利用了抗原抗体特异性结合的原理,将抗原固定制备成特异的亲和纯化柱,进行抗体纯化。利用该方法纯化得到的抗体纯度高,特异性也特别好。缺点是由于牵涉到抗原固定等操作,成本要比其他纯化方法高很多。
离子交换色谱原理是被分离物质所带的电荷可与离子交换剂所带的相反电荷结合,这种带电分子与固定相之间的结合作用是可逆的,在改变pH或者用逐渐增加离子强度的缓冲液洗脱时,离子交换剂上结合的物质可与洗脱液中的离子发生交换而被洗脱到溶液中。由于不同物质的电荷不同,其与离子交换剂的结合能力也不同,所以被洗脱到溶液中的顺序也不同,从而被分离出来。离子交换层析法详细介绍
分子筛层析法原理是应用蛋白质分子量或分子形状的差异来分离。当样品从色谱柱的顶端向下运动时,大的蛋白质分子不能进入凝胶颗粒从而被迅速洗脱;而较小的蛋白质分子能够进入凝胶颗粒中,且进入凝胶的蛋白在凝胶中保留时间也不同,分子量越大,流出时间就越早,最终分离分子大小不同的蛋白质。分子筛层析法详细介绍
亲和层析法、离子交换层析法、分子筛层析法等纯化方法为色谱纯化。除此之外,还可以利用沉淀法、双水相萃取法、高性能切向流过滤法等非色谱方法对抗体进行纯化。常用的非色谱纯化方法

南京德泰生物工程有限公司 Nanjing Detai Bioengineering Co.,Ltd. ©2025 All Rights Reserved