细胞生长曲线绘制-MTT法
摘要:通过MTT法可以得到细胞的生长曲线,也可对瞬时转染后的细胞进行检测,本文主要介绍了MTT的作用原理及实验操作要点。
MTT全称3-(4,5-二甲基噻唑-2)-2,5-二苯基四氮唑溴盐,商品名为:噻唑蓝。是一种黄颜色的染料。MTT主要有两个作用:① 药物(或其他处理方式如放射线照射)对体外培养的细胞毒性的测定(如细胞瞬时转染表达后可对细胞进行MTT检测)② 用于细胞增殖及细胞活性的测定,可以制得细胞生长曲线。
MTT法检测细胞存活和生长的主要机理是:活细胞中的某些物质(线粒体中的琥珀酸脱氢酶)能够和MTT反应,使MTT还原为水不溶性的蓝紫色结晶甲瓒(图1)并沉积在细胞中,而死细胞没有此功能。DMSO(二甲基亚砜)能够将此结晶(蓝紫色甲瓒)溶解,在酶联免疫检测仪490nm波长处测定其吸光值,能够间接的反应活细胞的数量。一定范围内,蓝紫色结晶沉淀的数量与细胞数成正比。目前MTT法因其灵敏度高,经济快速等优势被广泛的运用于细胞毒性试验,肿瘤药物的筛选、放射敏感性测定和对某些生物活性因子的活性检测等方面。MTT法也有自身的缺点,如MTT检测生产的蓝紫色产物(甲瓒)不溶于水,需被溶解后才能检测。一方面使得工作量增加,另一方面对实验结果的准确性产生一定的影响,且用于溶解甲瓒的有机溶剂对人体有一定的危害。细胞瞬时转染表达后的细胞也可做MTT实验,多数人不知道是先转染再做 MTT,还是先做MTT再进行瞬时转染,这里建议是先做转染,培养一段时间后(24/48h),重新接种至96孔板,加药两天左右,再进行MTT检测。
水不溶性的蓝紫色甲瓒
实验准备
- 仪器:酶联免疫检测仪,血球计数板,96孔板,离心管等
- 试剂:MTT溶液,胰蛋白酶,DMSO(二甲基亚砜),血清培养基
- MTT 溶液的配制
用PBS缓冲液溶解MTT粉末。PBS( ph=7.4)配置:Nacl (8g)+ Kcl( 0.2g)+Na2HPO4 (1.44g)+KH2PO4 (0.24g)调pH 7.4,定容至1L。
此处MTT 的浓度为:5mg/ml。称取 0.5克MTT粉末,溶于100 ml的磷酸缓冲液(PBS)中,用0.22μm滤膜过滤除去溶液里的细菌。在配制和保存的过程中,最好避光。如在超净台中配置该溶液,可将日关灯关掉操作,同时容器用铝箔纸包住(避光),4℃ 避光保存即可。使用勿超过两周,一旦MTT变色,即刻停止使用。建议是MTT最好现用现配,分装一定量的MTT粉末在EP管中,用的时候现配直接加到细胞培养板中操作方便也避免浪费。
此外,MTT具有致癌性,无论是配置还是实验都要注意做好防护准备。MTT对菌敏感,配置或保存的时候要保证无菌,且要避光。
在进行实验时,由于实验作用时间较短,因此可不避光,但是要将超净台的日光灯关掉,效果会更好。
实验操作
- 常规消化细胞,离心收集细胞沉淀,用血清培养基悬浮细胞,制成单细胞悬液,并用进行细胞计数
- 接种细胞:稀释细胞浓度至1×104 /ml。吸取200ul的细胞悬液加入到96孔板中(注意设置空白对照组)
- 对于瞬时转染的细胞,转染后24h消化细胞,重新接种至96孔板,培养18h加药两天后进行MTT检测
- 细胞培养:常规培养细胞,每两天换一次液
- 呈色:从细胞培养第二天开始,即可每天按照固定时间取出96孔板并加入MTT溶液20ul,37℃培养4h后,将孔中上清小心的吸去,加入150ul的DMSO,震荡10min,使沉淀充分溶解
- 在酶联免疫检测仪上设置490nm波长测定吸光值,进行检测并记录结果(取平均值)
- 每天取出96孔板重复操作,并记录结果
- 以时间为横坐标,吸光值为纵坐标绘制细胞生长曲线
结果分析
绘制结果应当如图2所示,呈现S形。与细胞培养计数法获得的生长曲线接近。前三天左右为停滞期,随后细胞进入对数生长期,最后进入稳定生长时期。
因为在相同体积内细胞数与吸光度成正比,所以在对数生长时期,曲线越倾斜(斜率越大),细胞的群体倍增时间越短。
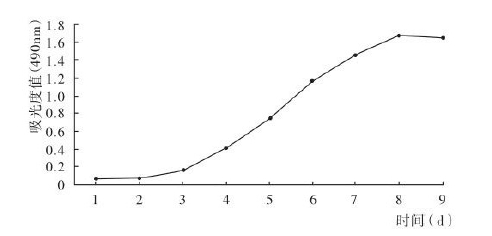
图2 MTT法实验结果
操作要点
- 实验设置空白对照组,步骤保持一致,一组只加培养基不加细胞,比色以空白调零
- MTT实验吸光度最后在0-0.7之间,超出这个范围则不是直线关系
- 加DMSO之前要尽量去掉培养液,便于DMSO溶解甲瓒颗粒进行比色测定
- 实验中使用各培养基的量,按照说明书操作(根据经验适时调整)
- 每孔细胞浓度维持在20个/ul,加20ul MTT,作用四小时后洗掉上清液。注意不要将甲瓒洗掉,然后每孔加150ul DMSO,振荡10分钟,然后测吸光值
- 细胞瞬转MTT检测,转染6h,24h或48h消化细胞进行重新接种,此时间根据细胞生长状态决定,一般在加药2天后进行MTT检测
利用细胞计数法也可以绘制生长曲线,具体的实验操作及结果分析方法请查看:细胞计数法绘制生长曲线
相关服务



