
记忆B细胞传统意义上被定义为生发中心(GC)B细胞的后代,表达同型转换和突变后的B细胞受体(BCRs)。然而,这不是记忆B细胞的唯一定义。我们在这里讨论小鼠的记忆B细胞,根据以下几个方面进行定义:(1)细胞表面标记;(2)多层级;(3)以T细胞依赖及GC依赖/非依赖的方式形成;(4)以不依赖T细胞的方式形成;(5)有自身免疫性疾病的小鼠模型。
未成熟B细胞表面表达BCR,这是一种与信号分子Igα/β相关的膜结合抗体。B细胞在骨髓中发育完成后,未成熟B细胞通过血液迁移到二级(外周)淋巴器官,如脾脏,在那里分化为成熟的B细胞。成人中,B细胞的发育在骨髓中进行,产生B1和B2 B细胞亚群。B1可以进一步细分为B1a和B1b,其中大部分B1a B细胞来自胎儿肝脏,而B2细胞分为滤泡(FO)和边缘区(MZ)B细胞。B1和MZ B细胞是天然抗体的来源,对非T细胞依赖(Ti)抗原起免疫反应。血液、脾脏和淋巴结中的主要亚群是FO B细胞,主要对T细胞依赖(Td)抗原做出反应。在B细胞被激活后,它们可以分化为记忆细胞和/或分泌抗体的浆细胞。
经过激活后,FO B细胞与滤泡树突状细胞(FDCs)和滤泡T辅助细胞(TFH)一起形成生发中心(GC),这是位于B细胞滤泡内的次级结构。FDCs以免疫复合物的形式捕获并保留抗原在其表面,TFH细胞被发现通过同源相互作用为B细胞提供分化信号。
GCs还支持BCR修饰,即类别转换重组(CSR)和体细胞超突变(SHM),这些过程需要激活诱导脱氨酶(AID)。GC可分为两个区,一个是B细胞进行克隆性扩增的暗区;一个是B细胞根据其与FDCs和T辅助细胞相互作用的能力进行选择的明区。当B细胞离开GCs时,它们分化为记忆B细胞或产生抗体的浆细胞,由于SHM和/或CSR导致效应功能的改变,表达的BCRs可能会经历亲和力成熟。
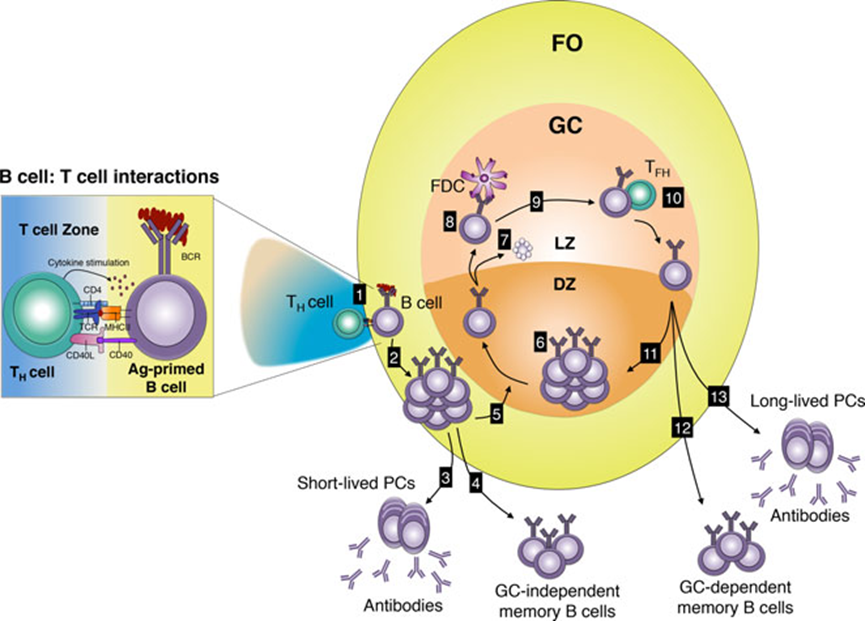
图1 记忆B细胞形成途径示意图
在人体中,记忆B细胞的比例远远高于小鼠,至少无病原体条件下的。并且人体记忆B细胞的主要特征是表达CD27,这是一种有抗原经历细胞的标志。在人类的CD27+B细胞中,存在着IgM和经历过SHM的同型转换的细胞。此外,缺乏CD27表达的记忆B细胞也有报道。有观察显示,CD27并不是小鼠记忆B细胞的适当标志物,并且由于记忆B细胞的数量少,在技术上难以仔细研究它们。为了避免这个问题,许多研究都依赖于使用杂交瘤和表达特定抗体的H链,单独或与确定的L链结合的转基因小鼠(TG),产生的B细胞可以高频率表达具有预先确定的抗原特异性的BCR。将此类结构体引入Ig的H(和L)链位点,也可以实现CSR,因此,研究可以表达同型转换抗原特异性BCRs的B细胞是可能的。
传统定义下,记忆B细胞为表达同型转换和大量突变BCRs的GC B细胞的后代。因此,对记忆B细胞的研究是针对表达同型转换抗原特异性BCR的B细胞,这些B细胞在GC反应停止后很久还存在。然而,最近在追踪记忆B细胞方面的进展使彻底研究这些细胞的性质成为可能,甚至是在不使用TG BCR的情况下。这揭示了记忆B细胞池在其生成、分化、功能、表型标记以及其BCR的SHM和/或同型转换水平方面具有未曾预见的异质性。此外,有证据表明还有一些途径可以形成记忆B细胞,这是一条Td但与GC无关的途径。不仅如此,甚至针对T细胞无关抗原,记忆B细胞也能形成。
下面根据以下几个方面讨论各种记忆B细胞群的定义:(1)细胞表面标记;(2)多层级;(3)以T细胞依赖性以及GC依赖性或非依赖性的方式形成;(4)以不依赖T细胞的方式形成;(5)有自身免疫性疾病的小鼠模型。
使用抗原特异性记忆B细胞的相对数量较高的TG小鼠模型,通过对细胞表面标志物进行研究,使记忆B细胞的定义得以确定,并且这在非TG小鼠中得到了证实。在这个系统中,B细胞表达一个明确的H链,与内源性λ1 L链结合,形成针对半抗原4-羟基-3-硝基苯乙酰 (NP)的特异性BCR。在这项研究中,用NP与鸡γ球蛋白(CGG)进行免疫后,刺激因子CD80被确定为记忆B细胞的标志物。可以与NP结合的IgM和IgG记忆B细胞被发现,并且其中60%以上表达CD80,其中大多数(70%)经过SHM。这也意味着在同型转换的记忆B细胞中,存在着表达非突变BCR的细胞,因此与传统的记忆B细胞的观点相悖。
后来CD80结合CD73和PD-L2两种标志物,区分了至少五种针对Td抗原NP-CGG免疫反应的记忆B细胞的亚群。由于在这五个亚群中都检测到了IgM和同型转换的细胞,说明亚群分类与同种型的表达无法关联。这些数据表明,记忆B细胞群的多样性是相当大的,存在一个谱系。这个谱系将由原生的记忆B细胞和其他更多的类记忆细胞组成,前者BCR不常进行同型转换且很少发生突变,而后者表达多种特异性标志物,更频繁地进行同型转换产生BCR且高突变含量高。

图2 B细胞的五种亚群的区分
在另一个模型系统中,使用黄色荧光蛋白(YFP)标记表达AID的细胞。其假设是,SHM和CSR所需的AID在GC反应期间被激活,因此YFP不仅会标记GC B细胞,也会标记它们的后代。这个模型允许长时间追踪YFP阳性细胞针对一种微粒状Td抗原的羊红血球细胞(SRBC)或可溶性Td抗原的NP-CGG所产生的免疫反应。通过这种方法,发现在SRBC免疫后长达8-12个月,都能检测到IgM和IgG记忆B细胞,而经过NP-CGG免疫后,只在3-4个月内可以检测到这些细胞,这表明对微粒抗原的反应产生的记忆会更持久,抗原的性质对记忆B细胞反应的持续时间很重要。此外,IgM记忆B细胞也有会继续分化。
对四个不同的YFP阳性记忆B细胞亚群以细胞表面标志物的方式进行区分。这些细胞可以根据IgM和IgG表达情况,以及它们是否与花生凝集素(PNA)结合进行划分。尽管所有的亚群都显示出了SHM的迹象,但无论哪种亚型,PNA阳性部分的频率都较高,并随时间而变化。此外,PNA阳性和PNA阴性的部分都是CD73和CD80阳性,只是它们的Fas(CD95)表达水平不同。记忆B细胞上CD73和CD80的表达情况与上文(1)讨论的记忆B细胞标志物一致。PNA和Fas也是GC B细胞的标志物,与此相一致的是,在SRBC免疫后的8个月内都可以检测到类似GC的结构。PNA+细胞的存在和GC反应开启了记忆B细胞再循环的可能性。事实上,IgM和IgG记忆亚群的过继转移显示,前者产生了GCs,而后者则分化为浆细胞,这也表明了记忆B细胞亚群的不同功能。由于AID的表达也可以发生在GC结构之外,YFP的阳性可能不是那些通过GC的细胞所独有的。尽管如此,这些数据与以前所认识到的更具可塑性和异质性的记忆B细胞反应相一致。基于这些结果,有人提出,B细胞记忆出现在多个层级,并具有不同的功能。
Ti B细胞反应基于抗原类型的区别可分为两种Ti-1和Ti-2。Ti-1抗原,例如细菌脂多糖(LPS),可以不考虑抗原的特异性而直接诱导B细胞的激活,它们还通过Toll样受体为B细胞提供第二个信号。Ti-2抗原,例如,肺炎球菌多糖或抗原2,4-二硝基苯偶联右旋糖酐(DNP-DE),都是高度重复的结构,可以交叉连接足够数量的BCR以完全激活抗原特异性B细胞。Ti-1抗原可以激活未成熟和成熟B细胞,而Ti-2抗原只激活成熟B细胞。Ti-2 B细胞反应主要由B1和MZ B细胞执行,并定位在滤泡外病灶。
多年来,人们认为针对Ti抗原的免疫反应不可能产生免疫记忆。早期的研究表明,初次免疫后,再次接触DNP-DE,产生的抗DNP抗体效果很差。然而,这种无反应性并不是由于缺乏抗原特异性的记忆B细胞,而是因为产生了抑制B细胞激活的半抗原特异性抗体。为了证明这一点,将DNP-DE诱导的脾脏细胞过继转移到已辐照的受体上,然后再进行刺激,结果是IgM反应增强。最近,有研究表明,B1b细胞在对Ti抗原的反应中会产生记忆B细胞,另外,B1a细胞似乎也会产生类似记忆细胞的特征。与Td B记忆细胞相比,Ti记忆B细胞在某些标志物方面出现了不同的表型。
小鼠模型中存在自身抗体会产生致病性,导致一些免疫性疾病,如系统性红斑狼疮(SLE),I型糖尿病和类风湿性关节炎(RA)。然而,产生的自身抗体本身并不一定会诱发自身免疫性疾病,相反,这些疾病的复杂的病理表现是由多个基因组合控制的。这些模型中的抗体可能来自于自体反应的记忆B细胞,尽管由于缺乏可靠的表面标记,这些细胞很难被定义和跟踪,因此大多数研究都依赖于‘传统的’记忆B细胞表型以及杂交瘤的建立。有证据表明,记忆B细胞和自身抗体都是在次级淋巴器官、受影响的局部器官中、GCs中以及在滤泡外的聚集物中形成的。
自身免疫性风湿病最常用的标志物之一是类风湿因子(RF),一种针对IgG的Fc部分的自身抗体。例如存在于易患狼疮的MRL/lpr小鼠中的自身抗体。这些自身抗体经历了CSR和SHM,而且RF特异性B细胞反应与外源性抗原引起的记忆B细胞反应非常相似。通过一个模型系统显示,具有针对RF(AM 14)特异性BCR的TG B细胞是以T 细胞依赖的方式被激活的,这发生在脾脏的T细胞区和红髓的边界,而不是在GCs中。与上面讨论的Td记忆B细胞相似,自身反应性的AM 14 B细胞可以进一步发展为CD73阳性的记忆B细胞,也可以发展为生命周期短的浆细胞。
B细胞在GCs中的存活取决于各种因素,包括细胞死亡受体Fas。该受体可以消除GC中的非特异性和自发性的B细胞;因此,如果Fas或FasL信号通路被破坏,自体反应记忆B细胞和浆细胞的生存和产生就会被允许。相反,在选择抗原特异性非自体反应的B细胞的过程中,其他逃逸信号确保了对Fas介导的细胞凋亡的抵抗。事实上,MRL/lpr小鼠出现的类似系统性红斑狼疮的综合征,包括肾小球肾炎、多动脉炎、关节炎和咽喉炎,是由于缺陷的Fas基因(lpr)与其它身份不明的突变基因的结合。
已知GCs的自发形成发生在自身免疫性小鼠的次级淋巴器官中,如自发性糖尿病NOD小鼠和狼疮模型 (MRL/lpr, PN, NZB, NZB/W, B6/lpr and BXSB 雄性小鼠),在没有免疫或感染的情况下,这些1至2个月年龄的小鼠已经发生了。基于用抗CD40配体抗体治疗后GCs的消退,在自身免疫中形成的GCs和由免疫引起的GCs都是T细胞依赖性的。已知在自身免疫环境中GCs的自发形成也发生在受影响的器官中,例如在糖尿病NOD小鼠的胰岛和胶原蛋白诱导的关节炎(RA最常用的小鼠模型)的滑膜组织中。在糖尿病NOD小鼠中,胰岛的GCs与次级淋巴器官中的GCs非常相似,因为它们都含有FDCs和T细胞,存在B细胞上调AID以及表达体细胞突变的寡克隆BCR组合。此外,GC B细胞可以在原地分化为可以产生针对胰岛素的抗体的浆细胞,也很可能分化为记忆B细胞。在患有胶原蛋白引起的关节炎的小鼠的关节中,大约50%的B细胞表达了GC标志物,如GL7和Fas,而同一小鼠脾脏中GC B细胞的相应比例约为10%。因此,很可能小鼠自身的GCs有助于记忆B细胞和浆细胞的产生。
综上,用于研究小鼠记忆B细胞的模型系统对实验结果很重要,因为它们在初次(和再次)免疫反应的持续时间、GCs的持久性和记忆亚群方面存在差异。实验结果还取决于抗原的剂量和类型、免疫的时间间隔以及用于定义记忆B细胞的标记物。然而,之前的数据表明,记忆B细胞的形成有两种途径,一种是是GC依赖性的,另一种不依赖。这两种途径都需要T细胞的帮助,并产生IgM和同型转换的记忆B细胞。如所讨论的转换和非转换记忆B细胞的五个亚群,也可能符合这两种途径,也许代表免疫反应的不同阶段。沿着其中一条途径,记忆B细胞将被生成并表达未变异的抗体,保护宿主免受各种入侵者变异体的伤害,而另一种途径将产生记忆性B细胞,它能以高亲和力、变异和同型转换的抗体迅速作出反应,并提供对同一抗原的再次变异的防御。Ti抗原也可以在同型转换和非转换B细胞中产生记忆反应。
在自身免疫条件下,自体免疫反应最初可能与那些外源性抗原所驱动的途径一样。然而,由于致病的自身抗体主要是突变的和同型转换的,这可能表明自身抗原的持续存在使反应偏向于长期的GCs和永久产生GC依赖性记忆B细胞和自身抗体产生的浆细胞。
决定B细胞命运的机制,也就是说,是什么使细胞走早期记忆B细胞而不是GC B细胞的途径,以及什么使GC B细胞分化为记忆B细胞而不是浆细胞,目前仍不清楚。到底是一个信号,还是几个信号将B细胞引向某条道路,目前还不完全清楚,也许是在内在和外部信号的影响下,例如抗体反馈机制。或者,决定性的事件可能只是随机的,例如,细胞分裂时抗原的不平等分配,产生的后代具有不同的呈现抗原和竞争T辅助细胞的能力。
参考文献
Bergmann B, Grimsholm O, Thorarinsdottir K, et al. Memory B Cells in Mouse Models[J]. Scandinavian Journal of Immunology, 2013, 78(2).

南京德泰生物工程有限公司 Nanjing Detai Bioengineering Co.,Ltd. ©2025 All Rights Reserved