
 大分子生物药近年来迅猛发展,特别是抗体药物偶联物(antibody-drug conjugate,ADC)是药物市场增长最快的生物药之一,在肿瘤的靶向治疗中发挥着重要的作用。ADC药物主要由3个部分构成,即单克隆抗体、细胞毒性小分子药物(有效载荷)以及抗体-药物连接子。药物进入体内后,可特异性与肿瘤细胞上高表达的靶点受体结合,经内化后进入细胞,通过连接子的裂解或抗体的降解释放有效载荷,发挥细胞毒作用。对ADC药物在非临床和临床研发阶段药代动力学研究有助于准确全面评估ADC在体内的作用机制和生物过程,为ADC药物开发早期的选择与优化,以及后期用药的有效性和安全性提供依据。复杂的结构和作用机制给ADC药物药代动力学研究带来诸多挑战,主要体现在药代动力学特征、目标分析物质、生物分析方法和数据解释的复杂性和多样性。
大分子生物药近年来迅猛发展,特别是抗体药物偶联物(antibody-drug conjugate,ADC)是药物市场增长最快的生物药之一,在肿瘤的靶向治疗中发挥着重要的作用。ADC药物主要由3个部分构成,即单克隆抗体、细胞毒性小分子药物(有效载荷)以及抗体-药物连接子。药物进入体内后,可特异性与肿瘤细胞上高表达的靶点受体结合,经内化后进入细胞,通过连接子的裂解或抗体的降解释放有效载荷,发挥细胞毒作用。对ADC药物在非临床和临床研发阶段药代动力学研究有助于准确全面评估ADC在体内的作用机制和生物过程,为ADC药物开发早期的选择与优化,以及后期用药的有效性和安全性提供依据。复杂的结构和作用机制给ADC药物药代动力学研究带来诸多挑战,主要体现在药代动力学特征、目标分析物质、生物分析方法和数据解释的复杂性和多样性。
ADC药物的PK研究主要内容包括ADC的体外稳定性、血药浓度-时间曲线、吸收、分布、代谢及排泄(ADME)过程。
临床试验开展前,需在人和动物(药理试验和/或毒理试验动物)的血浆和/或全血等介质中考察ADC的体外稳定性。在进行此项研究时需根据ADC的裂解释放特征,选择合适的检测目标,如检测ADC的变化和/或游离小分子化合物的生成情况。
如果小分子药物是新化合物,建议综合应用体内外研究方法,定性和/或定量检测手段,对小分子药物的系统暴露量、血浆蛋白结合及排泄特征、肿瘤和正常组织的摄取/分布特征等进行详细研究。必要时,对小分子药物代谢产物进行系统暴露量、代谢产物谱、分布、脱落方式、断裂点等系统研究。可通过检测小分子药物的脱落量对ADC进行体外血浆稳定性和动物体内的代谢稳定性研究。另外,建议考虑连接子的稳定性对小分子药物非预期提前释放及其对药代和药效、毒性等的影响。
ADC由抗体和细胞毒性小分子载荷明显不同的两种组分组成。从分子量大小和空间体积来讲,抗体组分占ADC药物的绝大部分,因此抗体特性强烈影响着ADC的PK特征,如靶点介导的药物清除、FcRn介受体循环、Fc效应功能。同样地,ADC的吸收、分布、代谢和排泄(ADME)特征也与未偶联抗体特性相关,包括缓慢消除、长半衰期、低分布容积及蛋白水解介导的分解代谢。ADC还有很多特征明显不同于未偶联抗体,这是在ADC开发期间需要考虑的,包括结合和游离小分子载荷的组织分布,ADC小分子组分的偶联方式对代谢和生物转化的影响以及游离小分子与其他小分子药物的药物相互作用等。
表1 小分子药物、单抗、ADC的PK特征比较
| 性质 | 小分子药物 | 单抗 | ADC |
|---|---|---|---|
| 分子量 | 通常<1k | ~150k | ~150k |
| PK试验 | 小分子药物及其相关代谢产物 | 所有的抗体 | 偶联物、所有的抗体、以及未偶联细胞毒性药物 |
| 免疫原性 | 无 | 有 | 有 |
| 分布 | 高分布容积;宽范围;可能超过血液和良好灌注组织的实际体积 | 分布容积接近血浆体积,有限的组织分布 | 分布容积接近血浆体积,有限的组织分布 |
| 代谢 | Ⅰ相Ⅱ相代谢;CYP450代谢约为药物75% | 蛋白水解、胞吞、吞噬作用分解代谢 | 蛋白水解分解代谢和CYD450代谢组合 |
| 排泄 | 主要通过胆汁分泌和肾脏排泄 | 短肽和氨基酸重复使用,或通过肾小球过滤消除 | 小分子药物和单抗的组合 |
| 半衰期 | 短 | 长 | 长 |
| 清除 | 低剂量:线性 高剂量:非线性 |
低剂量:非线性 高剂量:线性 |
低剂量:非线性 高剂量:线性 |
常用于表征ADC PK特征的分析物包括:包括总抗体(偶联和未偶联抗体)、偶联抗体(偶联至少一个小分子载荷的抗体)、抗体偶联药物和游离(未偶联)药物。不同的分析物的PK所反映的内容和意义不同,整体上构成了ADC药物在体内的PK全貌。
表2汇总了各分析物的分析方法、测定对象及其生物学意义。对于不同的分析物对象,应选用适合的生物分析方法,这对准确评估ADC在体内的作用机制和生物过程具有重要意义。体内生物大分子的定量分析通常采用配体结合分析(Ligand-binding assays, LBA)方法,小分子药物通常采用LC-MS/MS方法。
表2 ADC PK研究的分析物、分析方法与生物学意义比较
| 分析物 | 分析方法 | 测定对象 | 生物学意义 |
|---|---|---|---|
| 总抗体 | LBA | ADC偶联与未偶联抗体 | 对ADC抗体相关PK行为的最佳评估方法 |
| 偶联抗体 | LBA | 与至少一个载荷偶联的抗体 | 估算活性ADC浓度,ADC PK分析的基础 |
| 偶联药物 | LBA或Affinity LC-MS/MS | 与抗体偶联载荷总量 | 估算抗体相关的活性药物,反应ADC从体循环的清除及抗体上药物的解离 |
| 游离药物 | LBA或LC-MS | ADC释放的游离载荷及代谢产物 | 最常见和最强效药物种类的理论评估,毒性评价的基础 |
| DAR值分布 | Affinity LC-MS 或Affinity HIC | DAR | 估算血浆/血清中的DAR值变化 |
| 抗药抗体(ATA) | LBA | 抗药抗体(ATA) | 评价免疫原性对安全性,PK/PD的影响 |
总抗体分析测定样品中所有的抗体,包括结合型的抗体(DAR≥1)和未结合的抗体(DAR=0),可以用于评估ADC是否符合单克隆抗体的一般PK特征。如果总抗体分析表明ADC快速清除,则提示ADC不能与靶标有效结合,不适用于后期开发。
对于总抗体,通常使用LBA平台进行分析:使用抗原ECD或抗独特型抗体捕获ADC,并由与ADC抗体部分的不同表位结合的另一种抗体进行检测,包括非阻断型抗独特型抗体或通用抗人IgG试剂。需要注意的是,无论哪种检测形式,须保证体内各DAR值ADC均能被准确检测。DAR值高的ADC可能会由于小分子药物的立体位阻效应,影响抗体与捕获试剂或检测试剂的结合。
偶联抗体即与小分子载荷偶联的抗体(DAR≥1),是ADC的PK研究中最重要的分析物。其浓度变化取决于两个过程:载荷从抗体上完全解离,即DAR变为0;抗体部分通过酶解等方式解体。
对于偶联抗体,通常使用LBA平台进行分析:使用抗小分子载荷的抗体作为捕获试剂,以标记的抗原ECD或者抗独特型抗体或抗人IgG Fc抗体作为检测试剂。
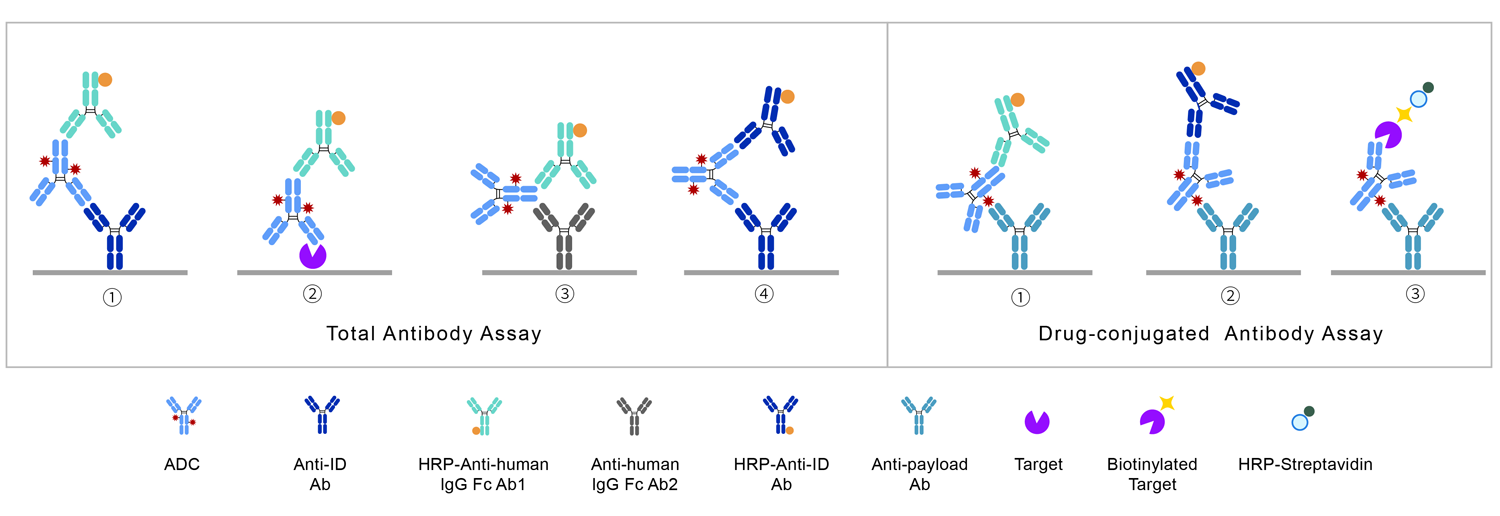
图1 总抗体/偶联抗体的LBA检测形式
偶联药物即所有偶联在抗体上的小分子载荷。偶联药物的浓度变化亦取决于两个同时进行的过程:载荷从抗体上完全解离;抗体部分通过酶降解等方式解体,此时载荷可能仍连接在抗体的碎片上,但这时已不能算作偶联药物。
偶联药物的测定可以采用LBA法,也可以采用亲和捕获LC-MS/MS法。LBA法测定选用抗原ECD、抗独特型抗体或抗人IgG抗体捕获ADC中的抗体部分,用抗小分子载荷的抗体作为检测试剂。亲和捕获LC-MS/MS法通常包含3步:①首先将ADC以某种方式(如蛋白A、抗独特型抗体、抗原等)捕获并与游离的小分子载荷分离;②以某种方法(化学反应或酶裂解)将小分子载荷从抗体上解离下来;③利用LC-MS/MS方法对解离下来的小分子进行定量。
游离药物即从抗体中解离下来的小分子载荷部分。游离药物的测定可以采用LC-MS/MS法或LBA法。通常认为LC-MS/MS更合适,因为其方法开发更简单,对这些结构类似的待测物特异性更强,在检测游离药物的同时,可以监测代谢产物的产生并对其定量。LBA法则需先利用乙腈沉淀去除蛋白,通过BSA-小分子载荷或抗小分子载荷的抗体包板,竞争法检测游离药物浓度。
ADC药物在体内随着小分子载荷的解离或不同DAR值ADC清除率的不同,其DAR值分布也在发生变化。研究DAR值分布有助于了解ADC药物在体内分解代谢过程,为ADC体内生物转化提供依据。常用测定血浆/血清样品DAR值分布的方法有亲和捕获LC-MS方法和亲和捕获疏水作用色谱(HIC)。这两种方法均可检测完整的分子量,用不同DAR值ADC去卷积化后的峰面积表征不同DAR值的相对丰度。
与其他大分子类似,ADC药物进入人体后,可诱导免疫反应,产生抗药抗体(anti-therapeutic antibody, ATA),导致ADC清除加快或药效降低,影响药物安全性、PK和药效。ATA有多种分析平台,包括桥连ELISA(bridging ELISA),药物用于捕获,标记的药物用于检测,电化学发光分析(ECL)、放射免疫沉淀法(RIP)、表面等离子共振(SPR)等,现在以桥连ELISA和ECL方法最为常用。
ADC的小分子组分与抗体的偶联方式可分为随机偶联和定点偶联,在使用随机偶联的情况下,不同数量的载荷连接至抗体的不同位点,形成不同DAR值的异构混合物。此外,ADC药物在体内经历复杂分解代谢和生物转化过程,导致ADC药物在体内具有异质性,存在着多种形式ADC分子。因此,构建合适的ADC生物分析方法需要考虑众多不同的因素。
(1)LBA方法具有高通量和高灵敏度等优势,是总抗体和偶联抗体定量的首选检测平台。理想状况下,采用的LBA方法对DAR的变化应不具有敏感性,但实际情况并非如此。可以认为,与ADC标准品的DAR相差程度越大的样品,其测得值的准确性越差。因此,构建总抗体和偶联抗体的分析方法时,需要考察DAR的变化对定量的影响。
(2)对于定量的分析方法要遵循等分子检测的原则,即在相同的分析条件下,一分子的标准品产生的检测信号与一分子的待测物产生的检测信号应该相同。如用于分析偶联抗体时,以靶标或者抗独特型抗体或者抗人IgG Fc抗体作为包被试剂,再以标记的抗小分子药物作为检测试剂。这种方法产生的结合信号除了反映ADC分子的数量外,还受到ADC分子中小分子数目的影响,该分析模式违反了等分子检测的原则,会导致药物偶联的抗体的检测不准确。
(3)ADC生物分析的挑战性同样源于与抗体偶联的小分子载荷的状态。ADC在体内经历的生物转化和分解代谢过程可能使ADC分子上的小分子载荷的结构发生改变,生成小分子载荷代谢产物。在此类情况下,构建偶联药物和游离药物的分析方法时,需要考察关键试剂与小分子载荷代谢转化后产物的结合情况。
(4)要了解各个关键试剂对不同状态下的ADC药物分子的结合反应性,基质中是否有游离靶标和结合蛋白的存在;并需要了解类似物与代谢物的情况,以及方法对抗药抗体的耐受程度等。
参考文献
[1]郭建军,高然,权腾飞,等.抗体偶联药物的药代动力学研究进展[J].药学学报,2015,50(10):1203-1209.
[2]秦秋平,陶亦敏,刘婷婷,等.ADC药物配体结合生物分析常见技术问题探讨[J].中国药物评价,2023,40(4):281-288.
[3]李秀立,陈笑艳,钟大放.抗体偶联药物研发中的生物分析[J].药学学报,2016,51(4):12.
[4] 季双敏,王玉珠,杨进波.抗体偶联药物的分子特点及其药代动力学研究考虑[J].中国临床药理学杂志,2021,37(6):6。
[5]于丝雨,刘晓东,刘李.抗体药物偶联物药动学研究进展[J].药学进展,2021,45(3):188-195.

南京德泰生物工程有限公司 Nanjing Detai Bioengineering Co.,Ltd. ©2025 All Rights Reserved